
 二氧化硫是大气的主要污染物之利用电化学原理可将SO2转化为主要化工原料-H2SO4,其工作原理如图所示下列说法正确的是( )
二氧化硫是大气的主要污染物之利用电化学原理可将SO2转化为主要化工原料-H2SO4,其工作原理如图所示下列说法正确的是( )| A. | 乙电极为正极,发生氧化反应 | |
| B. | H+从正极区通过交换膜移向负极区 | |
| C. | 甲电极的反应式为:SO2-2e-+2H2O═SO42-+4H+ | |
| D. | 乙电极上每消耗5.6LO2时,电路中通过1mol电子 |
分析 A、原电池中正极发生还原反应,负极发生氧化反应;
B、原电池中阳离子向正极移动;
C、二氧化硫在负极发生氧化反应生成硫酸根离子;
D、乙电极上每消耗1molO2时,电路中通过4mol电子.
解答 解:A、原电池中正极发生还原反应,负极发生氧化反应,所以乙电极为正极,发生还原反应,故A错误;
B、原电池中阳离子向正极移动,所以H+从负极区通过交换膜移向正极区,故B错误;
C、二氧化硫在负极发生氧化反应生成硫酸根离子,电极反应式为:SO2-2e-+2H2O═SO42-+4H+,故C正确;
D、乙电极上每消耗1molO2时,电路中通过4mol电子,而状况不知无法由体积求物质的量,故D错误;
故选C.
点评 本题考查化学电源新型电池,为高频考点,明确正负极的判断、离子移动方向即可解答,难点是电极反应式的书写,易错选项是D.


科目:高中化学 来源: 题型:解答题
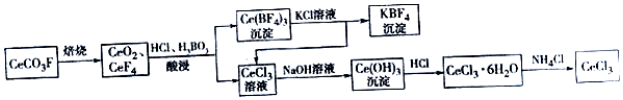
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定中和反应反应热实验中,为了充分反应,应将NaOH溶液缓缓倒入盐酸中 | |
| B. | 配制FeCl3溶液时,将FeCl3,晶体溶解在较浓的盐酸中,再加蒸馏水稀释到所需浓度 | |
| C. | 用盐酸滴定NaOH溶液时,左手控制酸式滴定管活塞,右手振荡锥形瓶,眼睛注视滴定管内液面 | |
| D. | 检验Fe(NOs)2晶体是否变质时,将Fe(NO3)2样品溶于稀H2SO4后,再滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y<Z<W | |
| B. | X元素的最高正价和最低负价的绝对值相等 | |
| C. | Y的单质化学性质很稳定,不与任何金属发生反应 | |
| D. | 工业上通常用W和R形成的化合物来冶炼金属W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和反应未完成前随着NaOH溶液的滴加,-OOCCH2COO-的物质的量浓度逐渐升高 | |
| B. | 若滴入的NaOH溶液的体积=10mL时溶液温度最高,则丙二酸的物质的量浓度=0.1mol•L-1 | |
| C. | 在丙二酸未完全中和前,随着NaOH的滴加,水的电离程度逐渐增大 | |
| D. | 若忽略丙二酸氢根离子的电离和水解,丙二酸根离子的水解常数约为7.14×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池不能用水溶液作为电解质 | |
| B. | 放电时,Li+在电解质中由负极向正极迁移 | |
| C. | 充电时,若转移1 mol e-,阴极电极将增重7g | |
| D. | 放电时,正极的电极反应式为AlLi-e-═Li++Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O | |
| B. | 硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+Fe2+ | |
| C. | 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO32-=Al2(CO3)3↓ | |
| D. | 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=NO3-+NO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L NH3中含有6.02×1022个共价键 | |
| B. | 100 mL 1 mol/L 的NaHSO4溶液中含有6.02×1022个Na+ | |
| C. | 将4 g NaOH溶于100 g蒸馏水,所得溶液物质的量浓度是0.1 mol/L | |
| D. | 电解含溶质16.0g的CuSO4溶液,能产生1.6gO23.2g金属Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com