
| 2.0��10-33 |
| (10-9)3 |


 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��� | ���������� | ���� |
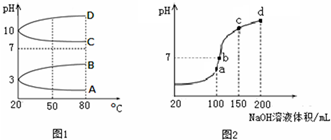
| A | ��0.1mol?L-1��ˮϡ�ͳ�0.01mol?L-1�����pH��11.1���10.6 | ϡ�ͺ�NH3?H2O�ĵ���̶ȼ��� |
| B | ��ij��ɫ��Һ�еμ�ϡ���������μ��Ȼ�����Һ��������ɫ���� | ����Һ��һ������SO42- |
| C | ��ij����ͨ��Ʒ����Һ��Ʒ����Һ��ɫ | ������һ����SO2 |
| D | ��ZnS�����ϵμ�����ͭ��Һ��������Ϊ��ɫ | ͬ���£�KsP��ZnS����KsP��CuS�� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A���ǻ����ᣨHOCH2COOH���������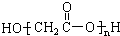 |
B��H2O2�ķ��ӽṹģ��ʾ��ͼ�� |
| C����CS2��PCl5�и�ԭ���������ܴﵽ8���ӵ��ȶ��ṹ |
| D�����ۺ���ά�ص�ʵ��ʽ��Ϊ CH2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������̫���ܵ���е�����̫���ܵ�ء��ྦྷ��̫���ܵ�ء�GaAs̫���ܵ�ؼ�ͭ��������Ĥ̫���ܵ�صȣ�
������̫���ܵ���е�����̫���ܵ�ء��ྦྷ��̫���ܵ�ء�GaAs̫���ܵ�ؼ�ͭ��������Ĥ̫���ܵ�صȣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
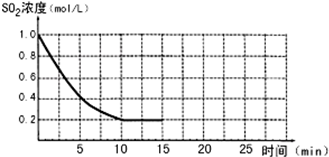 ��֪��2SO2��g��+O2��g��?2SO3��g������H=-196kJ/mol��850Kʱ����2L�̶��ݻ����ܱ������г���2mol SO2��2mol O2��10���Ӻ�ﵽƽ�⣬SO2Ũ�Ⱥ�ʱ���ϵ��ͼ��
��֪��2SO2��g��+O2��g��?2SO3��g������H=-196kJ/mol��850Kʱ����2L�̶��ݻ����ܱ������г���2mol SO2��2mol O2��10���Ӻ�ﵽƽ�⣬SO2Ũ�Ⱥ�ʱ���ϵ��ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �ŵ� |
| ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/�� | 25 | t1 | t2 |
| ˮ�����ӻ����� | 1��10-14 | a | 1��10-12 |
| A����25��t1��t2����a��1��10-14 |
| B��t2��ʱ����һ�����ʵ���Ũ�ȵ�����������������Һ�кͺ����û����ҺpH=7����Һ������ |
| C��25��ʱ��ijNa2SO4��Һ��c��SO42-��=5��10-4mol/L��ȡ����Һ1 mL��ˮϡ����10mL����ϡ�ͺ���Һ��c��Na+����c��OH-��=1000��1 |
| D��t2��ʱ����pH=11�Ŀ�������ҺV1 L��pH=1��ϡ����V2 L��ϣ����û����Һ��pH=2����V1��V2=11��9�����Ϻ���Һ�����Ϊԭ����Һ���֮�ͣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| X | Y | ||
| Z | M | R |
| A����̬�⻯���ȶ��ԣ�X��Y |
| B������������ˮ��������ԣ�Y��M |
| C��R���������ˮ���������ӻ����� |
| D��Z��M��R��ԭ�Ӱ뾶���μ�С������ϼ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������ƹ�����Դ��ʵ�ֵ�̼�����;��֮һ |
| B����ѧҩƷ�Ż�Ҫ������ˮ����ĭ�������� |
| C��ʳƷ���Ӽ����ܸ���ʳ��ζ���ȣ���������ʹ�� |
| D����ʯȼ��ȼ�պ�ҵ�����еĵ���������ǵ��¡�������������Ԫ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com