
分析 氢氧燃料碱性电池中,正极上氧气得电子和水反应生成氢氧根离子,负极上氢气失电子和氢氧根离子反应生成水,在得失电子相同条件下将正负极电极反应式相加即得电池反应式.
解答 解:氢氧燃料碱性电池中,正极上氧气得电子和水反应生成氢氧根离子,负极上氢气失电子和氢氧根离子反应生成水,在得失电子相同条件下将正负极电极反应式相加即得电池反应式,则正极、负极、电池反应式分别为O2+2H2O+4e-=4OH-、2H2+4OH--4e-═4H2O、O2+2H2=2H2O,
故答案为:O2+2H2O+4e-=4OH-;2H2+4OH--4e-═4H2O;O2+2H2=2H2O.
点评 本题考查电极反应式的书写,为高频考点,侧重考查学生分析判断能力,明确各个电极上发生的反应是解本题关键,注意结合电解质溶液酸碱性书写,如果是酸性条件下,则负极上生成氢离子,正极上生成水.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中Na+浓度增大,有H2放出 | |
| B. | 溶液中Na+数目减少,有H2放出 | |
| C. | 溶液中Na+与OH-浓度都增大,有H2放出 | |
| D. | 溶液中OH-数目增大,有H2放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
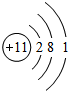 它的电子数为11,在化学反应中容易失去1 个电子成为Na+ (离子符号)
它的电子数为11,在化学反应中容易失去1 个电子成为Na+ (离子符号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | KNO3 | C. | MgSO4 | D. | AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
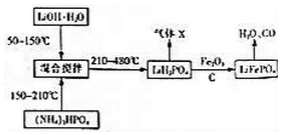
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
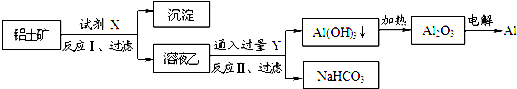
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com