
| A. | 盖斯 | B. | 勒•夏特列 | C. | 门捷列夫 | D. | 凯库勒 |
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:解答题
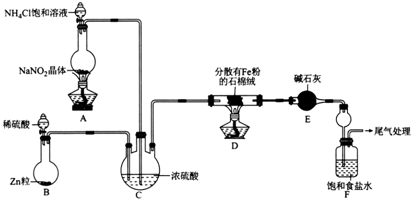
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=4 | |
| B. | S2O32-是还原剂 | |
| C. | 将Y均匀分散到水中形成的体系具有丁达尔效应 | |
| D. | 每有3 mol Fe2+参加反应,反应中转移的电子总数为5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出),请回答下列问题:
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出),请回答下列问题: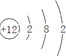 ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 | B. | 3 mol•L-1 | C. | 1mol•L-1 | D. | 0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

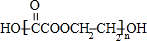 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
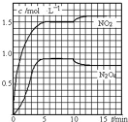 向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )
向2L 的密闭容器中充入7.6molNO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)═2NO2(g)②2NO2(g)═N2O4(g)测得 NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min 后升高并维持容器的温度为T2℃.下列说法正确的是( )| A. | 前 5min 反应的平均速率 v(N2O4)=0.36mol•L-1•min-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 若起始时向该容器中充入3.6molNO 2和 2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% | |
| D. | 反应①、②均为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com