
����Ŀ��������ͼ��ʾ��װ���ռ�����4�����壺��NO2����NH3����NO����SO2 �� 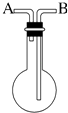
��1������ƿ�Ǹ���ģ�����B�ڽ��������ռ��������� �� ����A�ڽ��������ռ��������� ��
��2��������ƿ�ڳ���ˮ�����ռ��������� �� ����Ӧ���ڽ��룮
��3������ƿ��װ������Ũ���ᣬ���ܱ������������ �� ����Ӧ���ڽ��룮
��4���ڱ�״���£���NO�������������ƿ������ƿ������ˮ�У�����ƿ������ͨ��O2 �� ƿ��Һ��仯����� �� ������ƿ����Һ����ɢ��������ƿ����Һ�����ʵ����ʵ���Ũ��ΪmolL��1 ��
���𰸡�
��1���٢ܣ���
��2���ۣ� A
��3���ڣ� B
��4�������� ![]()
���������⣺��1����B�ڽ��������ռ��������ܶ�Ӧ�ô��ڿ����������������У���NO2����SO2��
����A�ڽ��������ռ������壬���൱�������ſ�������������ܶ�С�ڿ���������������Ϊ����NH3��
�ʴ�Ϊ���٢ܣ��ڣ���2��������ƿ�ڳ���ˮ�������ռ���ˮ��Ӧ��������ˮ�����壬�ܹ�������ˮ���ռ�������Ϊ����NO������Ӧ�ôӶ̵���A������Һ��ӳ�����B�ų���
�ʴ�Ϊ���ۣ�A����3��Ũ����Ϊ���Ը�������ܹ���Ũ���ᷴӦ�ļ������岻����Ũ��������ڰ�������������ʱ������Ӧ�ôӳ�����B������
�ʴ�Ϊ���ڣ�B����4���ڱ�״���£���NO�������������ƿ������ƿ������ˮ�У�����ƿ������ͨ��O2���ᷢ����Ӧ��4NO+2H2O+3O2=4HNO3������һ���������٣�ƿ��Һ���������
����ƿ���ݻ�ΪVL��������VLһ�����������ʵ���Ϊ��n��NO��= ![]() =
= ![]() mol�����ݵ�ԭ���غ㣬��Ӧ��������������ʵ���Ϊ��
mol�����ݵ�ԭ���غ㣬��Ӧ��������������ʵ���Ϊ�� ![]() mol����Ӧ����������ʵ���Ũ��Ϊ��
mol����Ӧ����������ʵ���Ũ��Ϊ�� ![]() =
= ![]() mol/L��
mol/L��
�ʴ�Ϊ�������� ![]() ��
��
��1����B��������Ϊ�����ſ������ռ���������ܶȴ��ڿ������ܶȣ���A������Ϊ�����ſ������������ܶ�С�ڿ�����ע�ⲻ��ʹ���ſ�����ˮ��NO����2����ˮ���ռ�����ʱ�����岻����ˮ��Ӧ����ˮ���ܽ�Ƚ�С���������������������������Ȳ���ʹ����ˮ���ռ�������Ӧ�ò��á��̽�������������3��Ũ����Ϊ���Ը���������ܸ���������壻��������ʱ������Ӧ�ôӳ����ܽ������̵��ܳ�������4������һ��������������ˮ�ķ�Ӧ����ʽ���з���Һ��仯�������ƿ���ݻ������ݵ�ԭ���غ�������Ӧ������������ʵ������ٸ������ʵ���Ũ�ȵĸ�������ϡ�͵����ʵ���Ũ�ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Ҫ�ɷ֣�Fe3O4��Fe2O3��FeO���õ��̷�����FeSO47H2O������ͨ���̷��Ʊ�����[FeO��OH��]���������£����� ![]() ��Һ
��Һ ![]() �̷�
�̷� ![]() ���� ��֪��FeS2�����ƾ�������ˮ����˵������ȷ���ǣ�������
���� ��֪��FeS2�����ƾ�������ˮ����˵������ȷ���ǣ�������
A.����٣�������������ܽ�����
B.����ڣ��漰�����ӷ�ӦΪFeS2+14Fe3++8H2O�T15Fe2++2SO42��+16H+
C.����ۣ�����Һ���ȵ��н϶�����������������Ƚ�Һ�����ɣ��ɵô����̷�
D.����ܣ���Ӧ�������Ʋ�����ʹ�����л���Fe��OH��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���о��к���ɫ����������Աȷ������Ľ��۲���ȷ���ǣ�������
|
|
|
�� | �� | �� |
A.�ɢ��еĺ���ɫ���壬�ƶϲ���������һ���ǻ������
B.����ɫ���岻�ܱ�������ľ̿��Ũ��������˷�Ӧ
C.�ɢ�˵��Ũ������лӷ��ԣ����ɵĺ���ɫ����Ϊ��ԭ����
D.�۵���������м���CO2 �� �ɴ�˵��ľ̿һ����Ũ���ᷢ���˷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����32.64gͭ��140mLһ��Ũ�ȵ����ᷴӦ��ͭ��ȫ�ܽ⣬������NO��NO2��������ڱ�״���µ����Ϊ11.2L����ش�
��1��NO�����ΪL��NO2�����ΪL��
��2��������������ȫȫ�ͷź�����Һ�м���VmLamolL��1��NaOH��Һ��ǡ��ʹ��Һ�е�Cu2+ȫ��ת��Ϊ��������ԭ������Һ��Ũ��ΪmolL��1 ��
��3����ͭ������պ÷�Ӧ��ȫ����ԭ������Һ��Ũ��ΪmolL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȡ�����������Ȫʵ�飨ͼ�мг�װ�þ�����ȥ���� 
��1��д��ʵ������ȡ�����Ļ�ѧ����ʽ ��
��2���ռ�����Ӧʹ������Ҫ�õ�����İ�����ѡ�����������
��3����ͼ����ʾװ�ý�����Ȫʵ�飬�ϲ���ƿ��װ������İ�����������Ȫ�IJ����� �� ��ʵ���ԭ���� ��
��4�����ֻ�ṩ��ͼ����ʾװ�ã���˵��������Ȫ�ķ�����
��5��д�������������Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ͼ��ʾ�����ת����ϵ������A Ϊ���ʣ��Իش�

��1��д���������ʵĻ�ѧʽ��C____________��H_________________��
��2��д��A��ˮ������Ӧ�Ļ�ѧ����ʽ___________________________________��
��3��ʵ���ұ���B��Һʱ��������������A����ԭ����___________________________________��
��4��д��Eת���F�Ļ�ѧ����ʽ___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ƴ�Ư�۾���Ŀ��
A.ת��Ϊ���ȶ����������������B.ת��Ϊ������ˮ������
C.����ȵ���������D.��ǿƯ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25����101kPa �����µ��Ȼ���(HCl)����49.6 L��ͨ��127 mL ˮ��( ��֪ˮ���ܶ�Ϊ1.00g��cm-3)���õ��ܶ�Ϊ1.19g.cm-3�����ᡣ(��֪��25����101kPa�����£�����Ħ�����Ϊ24.8 L��mol -1)
��1�������������ʵ����������Ƕ���?________________
��2����������HCl �����ʵ���Ũ���Ƕ���?_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص���ʵ�˵������ȷ����(����)
A.������ˮ�ɵ��磬�����ǵ����
B.����������ʱ�ܵ��磬�����������ǵ����
C.Һ̬��ͭ�����Ժܺã�����ͭ�ǵ����
D.��������ˮ��Һ�ĵ����Ժܺã����Զ��������ǵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com