
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做( )
A.正极 B.负极 C.阴极 D .阳极
.阳极
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
充分燃烧一定量丁烷时放出的热量xQ,完全吸收它生成的CO2生成正盐,需5mol/L的KOH溶液100ml,则丁烷的燃烧热为( )
A.16xQ B.8xQ C.4xQ D.2xQ
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,NO2跟NH3可以发生反应生成N2和H2O,反应方程式为6NO2+8NH3=7N2+12H2O。请回答:
(1)标明电子转移的方向和数目;
(2)氧化产物与还原产物的质量比是 ;
(3)若经氧化得到的N2比经还原得到的N2多2.8g,求参加反应的NO2 和NH3的质量各是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
氮氧化铝(AlON)是一种透明高硬度防弹材料,可以由反应Al2O3+C+N2=2AlON+CO(高温)合成,下列有关说法正确的是
A.氮氧化铝中氮的化合价是-3
B.反应中氮气作氧化剂
C.反应中每生成5.7g AlON 同时生成1.12 L CO
D.反应中氧化产物和还原产物的物质的量之比是2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
C、O、Na、Al、S、Cl是常见的六种元素
(1)C元素位于元素周期表第 周期,第 族;C元素的一种同位素可以测定文物年代,这种同位素的符号为
(2)用“大于”“小于”或“等于”填空
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- Al3+ | H2SO4 HClO4 | O2- S2- | 35Cl 37Cl |
(3)① CaCO3和适量HCl溶液反应时,每产生4.4 g 气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为 。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示

请用离子方程式表示B-C段发生的反应:
(4)氢气、氧气常用来作燃料电池,写出电解质为氢氧化钠溶液时
负极上的电极方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
已知化学反应A2(g)+B2(g)===2AB(g) ΔH= Q kJ·mol-1,其能量变化如下图所示,
则Q的值正确的是 ( )
A. a-b B. a
C.-b D. b-a
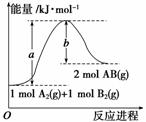
查看答案和解析>>
科目:高中化学 来源: 题型:
在一容积可变的密闭容器中,aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数减小了 D.化学计量数关系a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NaNO2的化学式量为69,则500mL1.0 mol·L-1NaNO2溶液含有溶质质量为
A.13.8g B.69g C. 34.5g D.138g
查看答案和解析>>
科目:高中化学 来源: 题型:
为证明Fe3+具有较强的氧化性,
甲同学做了如下实验:将Cu片放入Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。
已知:
| 水解反应 | 平衡常数(K) |
| Fe3+ + 3H2O | 7.9 × 10-4 |
| Fe2+ + 2H2O | 3.2 × 10-10 |
| Cu2+ + 2H2O | 3.2 × 10-7 |
请回答:
(1)稀硝酸和Cu反应的化学方程式为 。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、稀硝酸
方案:
。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色, pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化。 |
①根据实验现象写出发生反应的离子方程式: 。
②导致实验过程中溶液pH略有上升的可能原因是
。
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com