
 2NH3(g) ��H=��93.0kJ /mol�����ݱ�����һ�������£�2N2(g)+6H2O(l)
2NH3(g) ��H=��93.0kJ /mol�����ݱ�����һ�������£�2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ��H=" +1530.0kJ" /mol��
4NH3(g)+3O2(g) ��H=" +1530.0kJ" /mol��| A������������ٱ仯������ƽ�� |
| B�������ܶȲ��ٱ仯����δƽ�� |
| C��ƽ�����װ����ͨ��һ����Ar��ѹǿ���䣬ƽ�ⲻ�ƶ� |
| D��ƽ���ѹ��װ�ã����ɸ���NH3 |
 ��3�֣����1�֣��յ�1�֣��ӳ���1�֣�
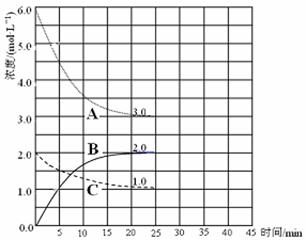
��3�֣����1�֣��յ�1�֣��ӳ���1�֣� 2NH3(g)����ͼ��֪��ǰ25min��A��Ũ����6.0mol/L��СΪ3.0mol/L��C��Ũ����2.0mol/L��С��1.0mol/L��B��Ũ����0������2.0mol/L����A��C��B�ı仯Ũ�ȷֱ�Ϊ3.0mol/L��1.0mol/L��2.0mol/L�����A��C��B�ֱ��ʾ�����������Ͱ�����Ũ���淴Ӧʱ��仯�����ߣ�������ǰ25min��������Ũ����6.0mol/L��СΪ3.0mol/L����仯Ũ��Ϊ3.0mol/L����v(H2)=��c(H2)/��t="3.0mol/L��25min" ="0.12" mol / (L��min)���۸����������ݷ��ɵã�
2NH3(g)����ͼ��֪��ǰ25min��A��Ũ����6.0mol/L��СΪ3.0mol/L��C��Ũ����2.0mol/L��С��1.0mol/L��B��Ũ����0������2.0mol/L����A��C��B�ı仯Ũ�ȷֱ�Ϊ3.0mol/L��1.0mol/L��2.0mol/L�����A��C��B�ֱ��ʾ�����������Ͱ�����Ũ���淴Ӧʱ��仯�����ߣ�������ǰ25min��������Ũ����6.0mol/L��СΪ3.0mol/L����仯Ũ��Ϊ3.0mol/L����v(H2)=��c(H2)/��t="3.0mol/L��25min" ="0.12" mol / (L��min)���۸����������ݷ��ɵã� 2NH3(g)
2NH3(g) =
= ��0.15��������λ��Ч���֣�
��0.15��������λ��Ч���֣� 2NH3(g)
2NH3(g) NH3?H2O+H+
NH3?H2O+H+ =
= =1.0��10��9
=1.0��10��9 =
= =1.0��10��9����x 2=1.0��10��10��x=1.0��10��5������pH=��lgc(H+)=5��
=1.0��10��9����x 2=1.0��10��10��x=1.0��10��5������pH=��lgc(H+)=5��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 CO(g) + 3H2(g) ��H =" +206.2" kJ/mol
CO(g) + 3H2(g) ��H =" +206.2" kJ/mol CO2(g) +4H2(g) ��H = +165.0kJ/mol
CO2(g) +4H2(g) ��H = +165.0kJ/mol CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£�
CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£�| T / �� | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
 ����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ����ͼ�е�B�㴦��NH3��ƽ��ת���ʡ�
����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ����ͼ�е�B�㴦��NH3��ƽ��ת���ʡ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��
�� ��һ283.0 kJ
��һ283.0 kJ ��һ726.5��kJ
��һ726.5��kJ ����ش��������⣺
����ش��������⣺ ��
�� ������300�棩��
������300�棩��
 ʱ���ӷ�Ӧ��ʼ����Ӧ�ﵽƽ�⣬���ɼ״���ƽ������Ϊ��
ʱ���ӷ�Ӧ��ʼ����Ӧ�ﵽƽ�⣬���ɼ״���ƽ������Ϊ��
 ʱ��ƽ�ⳣ����
ʱ��ƽ�ⳣ���� ʱ��С
ʱ��С �䵽
�䵽 ���ﵽƽ��ʱ
���ﵽƽ��ʱ ����
���� �¶�ʱ����1mol CO2��3mol H2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2��ת����Ϊa�����ʱ�����ڵ�ѹǿ����ʼѹǿ֮��Ϊ___________��
�¶�ʱ����1mol CO2��3mol H2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2��ת����Ϊa�����ʱ�����ڵ�ѹǿ����ʼѹǿ֮��Ϊ___________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��330 kJ | B��276.67 kJ | C��130 kJ | D��76.67 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A����100 �森101 kPa�����£�Һ̬ˮ��������Ϊ40��69 kJ��mol-1����H2O(g) H2O(l) �Ħ�H ="+" 40��69 kJ��mol-1 H2O(l) �Ħ�H ="+" 40��69 kJ��mol-1 |
| B����֪MgCO3��Ksp = 6��82 �� 10-6�������к��й���MgCO3����Һ�У�����c(Mg2+) = c(CO32-)����c(Mg2+) �� c(CO32-)= 6��82 �� 10-6 |
| C�������£���0��10 mol��L-1��NH3��H2O��Һ�м�������NH4Cl���壬��ʹNH3��H2O�ĵ���Ƚ��ͣ���Һ��pH��С |
| D����֪�� |
| ���ۼ� | C��C | C=C | C��H | H��H |
| ����/ kJ��mol-1 | 348 | 610 | 413 | 436 |
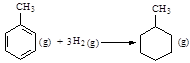 �Ħ�HΪ��384 kJ��mol-1
�Ħ�HΪ��384 kJ��mol-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 2NH3(g) ��H<0��ijʵ�齫3.0 mol N2(g)��4. 0 mol H2(g)�����ݻ�Ϊ10L���ܱ������У����¶�T1�·�Ӧ�����H2�����ʵ����淴Ӧʱ��ı仯����ͼ��ʾ��
2NH3(g) ��H<0��ijʵ�齫3.0 mol N2(g)��4. 0 mol H2(g)�����ݻ�Ϊ10L���ܱ������У����¶�T1�·�Ӧ�����H2�����ʵ����淴Ӧʱ��ı仯����ͼ��ʾ��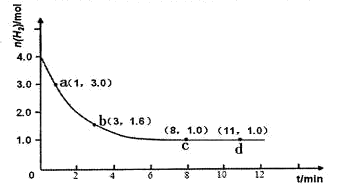

 CH3COO[Cu(NH3)3]?CO ��H<0��д�����CO�����ʵ�����һ���ʩ�� ��
CH3COO[Cu(NH3)3]?CO ��H<0��д�����CO�����ʵ�����һ���ʩ�� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������£�pH=5.6��NaHSO3��Һ��c( SO32-)-c( H2SO3)= 10-5.6-10-8.4 |
| B��ͬ��ͬѹ�£���ӦH2(g)��Cl2(g)��2HCl(g)�ڹ��պ͵�ȼ�����µĦ�H��ͬ |
| C�����ȷ�Ӧֻ���ڼ��������²��ܷ�������ˮ�����Ȳ����� |
| D�������İ�ˮ�����ᷴӦ������Һ������Ϊ���ԣ�������Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3(g) ��H="-Q" kJ��mol-1(Q��0)�����SO2��ת����Ϊ90%��
2SO3(g) ��H="-Q" kJ��mol-1(Q��0)�����SO2��ת����Ϊ90%��| A��1.8Q kJ | B��2Q kJ | C��Q kJ | D��0.9 QJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ��
�� ��Ӧ�����������仯������ͼ������ͼ���ж�������������ȷ����
��Ӧ�����������仯������ͼ������ͼ���ж�������������ȷ����
A���÷�Ӧ���Ȼ�ѧ����ʽΪ��N2(g)+3H2(g) 2NH3(g)��H=+92kJ/mol 2NH3(g)��H=+92kJ/mol |
B�� �����Ǽ������ʱ�������仯���� �����Ǽ������ʱ�������仯���� |
| C������������û�ѧ��Ӧ�ķ�Ӧ����ֵ���С |
D����Ӧ2NH3(g)  N2(g)+3H2(g) ��H=+92kJ/mol N2(g)+3H2(g) ��H=+92kJ/mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com