
【题目】科学家研究镉、铜对河蚬过氧化氢酶活性的影响,用一定浓度的镉、铜处理河蚬一段时间后,测得河蚬过氧化氢酶活性如表所示.
镉、铜对河蚬过氧化氢酶活性的影响
毒物 | 空白对照组 | a | 铜 | 镉+铜 | ||||||
质量浓度(μgL﹣1) | 0 | 50 | b | 150 | 50 | b | 150 | 50 | b | 150 |
酶活性(Umg﹣1) | 433 | 582 | 455 | 387 | 488 | 426 | 380 | 315 | 275 | 135 |
请回答下列问题:
(1)本实验的实验目的是 .
(2)表中a是 ,b为 .
(3)列举本实验需要控制的两个无关变量: .
(4)过氧化氢酶活性测定可用过氧化氢作为底物,用一定条件下单位时间内的 来表示.
(5)某学校兴趣小组的同学利用河蚬的新鲜的软体组织制成研磨液,比较过氧化氢酶和Fe3+的催化效率.研磨河蚬软体组织的目的是 .能否用河蚬过氧化氢酶作为实验材料来探究温度对酶活性的影响?为什么? .
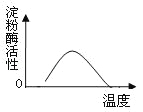
(6)在下面的坐标中画出酶活性与温度的关系曲线(画出大致趋势即可).
.
【答案】(1)探究不同浓度的镉、铜对河蚬过氧化氢酶活性的影响
(2)镉 100
(3)河蚬只数、河蚬生理状况、加入物质的量、培养时间等
(4)氧气的生成量(过氧化氢的减少量)
(5)使酶从软体组织内释放出来,增大过氧化氢酶与试管中过氧化氢分子的接触面积,从而加速过氧化氢的分解 不能,高温会使过氧化氢自行分解
(6)
【解析】
试题分析:分析表格:本题实验的目的是研究镉、铜对河蚬过氧化氢酶活性的影响,则实验组应是镉、铜以及镉+铜,所以表中a应是镉.可见本实验的自变量是毒物的种类和浓度,而且自变量的变化应有规律,即自变量的梯度差应该相同,所有表中b应是100.因变量是过氧化氢酶活性,无关变量为河蚬只数、河蚬生理状况、加入物质的量、培养时间等.
解:(1)分析表格数据可知:该实验自变量是不同浓度的镉、铜,因变量是氧化氢酶活性,故本实验目的是:探究不同浓度的镉、铜对河蚬过氧化氢酶活性的影响.
(2)题干说明为了研究用一定浓度镉、铜对河蚬过氧化氢酶活性的影响,实验组应是镉、铜以及镉+铜对其影响,因此a是镉.自变量的梯度差应该相同,所以b应是100.
(3)无关变量是除了实验变量外的其他因素,如河蚬只数、河蚬生理状况、加入物质的量、培养时间等都可以.
(4)测酶活性可以用单位时间内反应物的减少量或者产物的生产量都可以.
(5)研磨机体组织的目的是破坏细胞的结构,使细胞内容物释放出来,在此主要是让过氧化氢酶释放出来,增大过氧化氢酶与试管中过氧化氢分子的接触面积,从而加速过氧化氢的分解.过氧化氢自身在不同的温度下分解速率就不同,而实验应遵循单一变量原则,因此不能过氧化氢酶作为实验材料来探究温度对酶活性的影响.
(6)在一定温度范围内,随着温度的升高酶活性增强,超过一定温度范围,酶活性随着温度的升高而减弱.酶活性与温度的关系曲线见下图:

故答案为:(1)探究不同浓度的镉、铜对河蚬过氧化氢酶活性的影响
(2)镉 100
(3)河蚬只数、河蚬生理状况、加入物质的量、培养时间等
(4)氧气的生成量(过氧化氢的减少量)
(5)使酶从软体组织内释放出来,增大过氧化氢酶与试管中过氧化氢分子的接触面积,从而加速过氧化氢的分解 不能,高温会使过氧化氢自行分解
(6)


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
A. 从开始到平衡A的平均反应速率为0.3mol/(L![]() s)
s)
B. 从开始到平衡B的转化率为40%
C. x=2
D. 达到平衡状态时,C的体积分数为1/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.金刚石晶体中的最小碳原子环由12个碳原子构成
B.AlCl3晶体属于分子晶体
C.1molSiO2分子中含4molSi—O键
D.金刚石化学性质稳定,即使在高温下也不会和O2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 3Z(g)。此反应达到平衡的标志是( )
3Z(g)。此反应达到平衡的标志是( )
A. 容器内压强不随时间变化
B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为l:2:3
D. 单位时间消耗0.1molX同时生成0.3molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某化学反应过程中,生成物的量与时间的关系,图中a、b、c三条曲线不能反映下列哪种因素对生成物的量的影响( )

A. 不同的温度 B. 不同的pH值
C. 不同的底物浓度 D. 不同的酶浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X(g)和Y(g)可以相互转化:2X(g)![]() Y(g) ΔH<0。现将一定量X(g)和Y(g)的混合气体通入一体积为1 L的恒温密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。则下列说法不正确的是
Y(g) ΔH<0。现将一定量X(g)和Y(g)的混合气体通入一体积为1 L的恒温密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。则下列说法不正确的是

A.若混合气体的压强不变,则说明反应已达化学平衡状态
B.a、b、c、d四个点表示的反应体系中,表示化学反应处于平衡状态的只有b点
C.25~30 min内用X表示的平均化学反应速率是0.08 mol·L-1·min-1
D.反应进行至25 min时,曲线发生变化的原因是增加Y的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达
均正确的是

A.①是其他条件一定时,反应速率随温度变化的图像,则正反应ΔH>0
B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C.③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图像
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:N2(g)+3H2(g)![]() 2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g)。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3 mol H2、 2 mol N2 | 6 mol H2、 4 mol N2 | 2 mol NH3 |
达到平衡的时间/min | 5 | 8 | |
平衡时N2的浓度/(mol·L1) | c1 | 1.5 | |
NH3的体积分数 | φ1 | φ2 | |
混合气体的密度/(g·L1) | ρ1 | ρ2 |
下列说法不正确的是
A.容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3 mol·L1·min1
B.在该温度下甲容器中反应的平衡常数K=![]()
C.2ρ1=ρ2
D.2c1<1.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 糖类、油脂、蛋白质均能发生水解
B. 氨基酸均只含有一个羧基和一个氨基
C. 植物油能使溴的四氯化碳溶液褪色
D. 聚乙烯、油脂、纤维素均为高分子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com