
| ||
| A、①③⑥ | B、①③⑥⑧ |
| C、③④⑥⑦ | D、②③④⑤⑦ |
| ||


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:
| A、Al-Al2O3-Al(OH)3-NaAlO2 |
| B、Na-Na2O2-Na2CO3-NaOH |
| C、S-SO3-H2SO4-MgSO4 |
| D、Fe-FeO-Fe(OH)2-Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂的主要成分是高级脂肪酸的甘油酯,属于酯类 |
| B、天然油脂大多数是由混甘油酯构成的混合物 |
| C、油脂的水解反应叫做皂化反应 |
| D、油脂里饱和烃基的相对含量越大,熔点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中性溶液就是PH=7的溶液 |
| B、中性溶液是指c(H+)=c(OH-)的溶液 |
| C、酸与碱恰好完全中和所得的溶液是中性溶液 |
| D、不能使酸碱指示剂显色的溶液是中性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
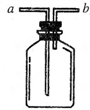 (1)现有人图所示装置,为实现下列实验目的,其中应以a端作为入口的是
(1)现有人图所示装置,为实现下列实验目的,其中应以a端作为入口的是查看答案和解析>>
科目:高中化学 来源: 题型:
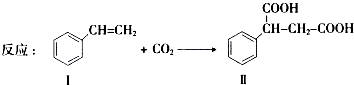
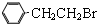 通过消去反应制备Ⅰ的化学方程式为
通过消去反应制备Ⅰ的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素.A、B元素的最高正价与最低负价的代数和均为零;C元素是植物生长三大营养元素之一;D的单质具有强氧化性,其氢化物能和一种半导体材料反应生成常温常压下的两种气体;E原子核外K层电子数与M层电子数相等;F原子的价电子数等于电子层数的两倍.请回答下列问题:
A、B、C、D、E、F、G为原子序数依次递增的7种短周期主族元素.A、B元素的最高正价与最低负价的代数和均为零;C元素是植物生长三大营养元素之一;D的单质具有强氧化性,其氢化物能和一种半导体材料反应生成常温常压下的两种气体;E原子核外K层电子数与M层电子数相等;F原子的价电子数等于电子层数的两倍.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com