
短周期元素X、Y、Z最外层电子数之和为15,X、Y在同一周期,X+、Z-具有相同的核外电子层结构。下列推测错误的是 )。
A.同主族元素中Z的氢化物稳定性最强
B.同周期元素中X的金属性最强
C.原子半径X>Y,离子半径X+>Y-
D.同周期元素中Y的最高价含氧酸的酸性最强
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
(1)根据表中数据,在该题图中相应位置上画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(2)体系中发生反应的化学方程式是
________________________________________________________________________;
(3)该反应达到平衡时反应物X的转化率α等于
________________________________________________________________________;

(4)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如上图所示),则曲线①、②、③改变的实验条件分别是:
①____________;②____________;③____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
A.0.1 mol·L-1 pH=7.82的NH4HCO3溶液中:c(HCO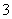 )>c(NH
)>c(NH )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.浓度均为0.1 mol·L-1的NH3·H2O溶液和NH4Cl溶液等体积混合:
[c(NH )+c(H+)]>[c(NH3·H2O)+c(OH-)]
)+c(H+)]>[c(NH3·H2O)+c(OH-)]
C.0.1 mol·L-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
D.0.1 mol·L-1 Na2S溶液与0.1 mol·L-1 NaHS溶液等体积混合:
2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量。
①4Ps,红)+5O2g)===2P2O5s) ΔH1
②4Ps,白)+5O2g)===2P2O5s) ΔH2
则ΔH1与ΔH2的关系正确的是 )。
A.ΔH1=ΔH2 B.ΔH1>ΔH2
C.ΔH1<ΔH2 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
能说明元素X原子的得电子能力强于元素Y原子的得电子能力的事实是
)。
A.元素周期表中元素X位于元素Y的上一周期
B.元素X的含氧酸的酸性强于元素Y的含氧酸的酸性
C.分别加热H2X、HY至500 ℃,只有HY发生分解
D.元素X与Y同主族,相同温度时其单质与铜反应分别生成Cu2X和CuY
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是用铁铆钉固定两个铜质零件的示意图,若将该零件置于潮湿空气中,下列说法正确的是( )。
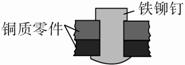
A.发生电化学腐蚀,铜为负极,铜极产生H2
B.铜易被腐蚀,铜极上发生还原反应,吸收O2
C.铁易被腐蚀,铁发生氧化反应:Fe-2e-===Fe2+
D.发生化学腐蚀:Fe+Cu2+===Cu+Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C5H12O的饱和一元醇与和它相对分子质量相同的饱和一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)
A.13种 B.14种 C.15种 D.16种
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为__________________(2分);
向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式为______________________ (2分)。
(2)请以FeSO4溶液、KI溶液、氯水为试剂探究Fe2+和I-的还原性强弱。
①提出假设:假设1:Fe2+还原性强于I-;假设2:_____________________________(1分)
②设计实验方案,写出实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
| 实验步骤(6分) | 预期现象与结论(2分) |
| 步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再_________ __ | 现象:溶液变成黄色。结论:可能是生成了Fe3+、也可能是生成了I2。 |
| 步骤2:___________________________
|
|
(3)利用(2)②中提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:
取少量样品溶于水,______________________________________________________。(3分)
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上,通过如下转化可制得KClO3晶体:
NaCl溶液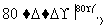 NaClO3溶液
NaClO3溶液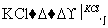 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式: NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ __________。
__________。
②Ⅱ中转化的基本反应类型是________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com