
 ②
② ③
③ ④
④ 其中能被氧化为含相同碳原子数的醛的是( )
其中能被氧化为含相同碳原子数的醛的是( )| A. | ①② | B. | 只有② | C. | ③④ | D. | ②③ |
分析 醇发生催化氧化反应的结构特点是:只有羟基相连碳的碳上有氢原子的才能发生氧化反应.要发生生成醛的反应必须是“伯醇(-CH2OH)”.
解答 解:醇发生催化氧化反应的结构特点是:只有羟基相连碳的碳上有氢原子的才能发生氧化反应,当羟基所在的碳原子上只有一个H原子时,被催化氧化为酮,当羟基所在的碳原子上有2个H原子时,被催化氧化为醛,即要催化氧化生成醛的反应必须是“伯醇(-CH2OH)”.而是“伯醇(-CH2OH)”的为②③,故选D.
点评 本题考查醇的消去反应,难度不大,注意醇发生氧化反应的结构特点是:只有羟基相连碳的碳上有氢原子的才能发生氧化反应.要发生生成醛的反应必须是“伯醇(-CH2OH)”.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
| 实验 | 步骤 | 操作 | 现象 |
| 一 | ① | 向试管A中加入2mLFeCl2溶液,滴加少量溴水,振荡 | 溶液变为黄色 |
| ② | 滴加少量KSCN溶液 | 溶液变为红色 | |
| 二 | ① | 向试管B中加入2mL FeCl2溶液和0.5mL苯,将胶头滴管伸入下层溶液,加入约0.5mL稀碘水 | 溶液变为黄色 |
| ② | 滴加少量KSCN溶液 | 溶液没有出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑨ | B. | ①④⑤⑨⑩ | C. | ①③④⑤⑦⑧⑨⑩ | D. | ①④⑤⑥⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 粗盐提纯中除泥沙的操作顺序是:溶解、过滤、蒸发 | |
| B. | 萃取操作时,所选萃取剂的密度必须要大于水的密度 | |
| C. | 蒸馏操作时,冷凝管从上面进水,从下面出水 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
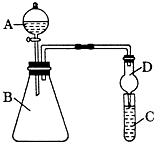 某同学为探究元素和化合物性质的递变规律,设计了如下系列实验.
某同学为探究元素和化合物性质的递变规律,设计了如下系列实验.| A中加入物质 | B中加入物质 | C中加入物质 | 实验结论 |
| 稀硫酸或盐酸 | 碳酸钠(或碳酸盐) | 硅酸钠溶液 | 酸性:盐酸>碳酸>硅酸 |
| 氢氧化钠溶液(强碱溶液) | 氯化铵(或铵盐) | 氯化铜溶液(难溶碱的可溶性盐溶液) | 碱性:氢氧化钠>一水合氨>氢氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| O | |
| S | |
| Se | Br |
| A. | 原子序数为34 | B. | H2Se比HBr稳定 | ||
| C. | 最高价氧化物的化学式是SeO2 | D. | 位于元素周期表第四周期第ⅣA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净物一定由分子组成 | |
| B. | 由同种分子构成的物质一定是纯净物 | |
| C. | 混合物一定是由两种以上元素构成的 | |
| D. | 含有氧元素的化合物都是氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
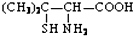 ,请写出青霉氨基酸可能具有的一种化学性质能与碱发生中和反应.
,请写出青霉氨基酸可能具有的一种化学性质能与碱发生中和反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com