
【题目】下列离子方程式不正确的是
A. 少量SO2气体通入次氯酸钠溶液中:SO2+3ClO-+H2O=SO42-+Cl-+2HClO
B. 氧化铁溶于HI溶液:Fe2O3+6H+=2Fe3++3H2O
C. 碳酸氢钠与过量Ba(OH)2溶液反应:HCO3-+OH-+Ba2+=BaCO3![]() +H2O
+H2O
D. 向硅酸钠水溶液中通入过量CO2气体:SiO32-+2H2O+2CO2=2HCO3-+H2SiO3![]()
【答案】B
【解析】
A. 次氯酸钠具有氧化性,可与二氧化硫发生氧化还原反应;
B. HI具有还原性,氧化铁溶于HI中,会发生氧化还原反应;
C. 碳酸氢钠少量,可以与Ba(OH)2按物质的量之比为1:1反应;
D. 根据强酸制弱酸的原理书写,其中CO2过量,则对应的盐为碳酸氢根离子。
A. 少量SO2气体通入次氯酸钠溶液中:SO2 + 3ClO- + H2O = SO42- + Cl-+2HClO,故A项正确;
B. 氧化铁溶于HI溶液中,发生氧化还原反应,其离子方程式为:Fe2O3+6H++2I- = 2Fe2++ I2+ 3H2O,故B项错误;
C. 碳酸氢钠与过量Ba(OH)2溶液反应:HCO3-+OH-+ Ba2+ = BaCO3![]() + H2O,故C项正确;
+ H2O,故C项正确;
D. 向硅酸钠水溶液中通入过量CO2气体:SiO32- + 2H2O+2 CO2 = 2HCO3-+ H2SiO3![]() ,故D项正确;
,故D项正确;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图是工业上铝土矿(含有Al2O3和Fe2O3等)冶炼铝的工艺流程图:

(1)操作①的名称是:___________。操作①剩余的矿渣主要成分为:__________(填化学式)。
(2)图中①为了提高NaOH和铝土矿的反应速率可采取哪些措施__________________________(写两条)。
(3)图中①的离子方程式_____________________________________________________________;图中③、④的化学反应方程式______________________________________________________。
(4)洗涤Al(OH)3沉淀的具体操作是: ________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到实验目的的是

A. 用甲装置比较碳、氮和硅三种元素的非金属性强弱
B. 用乙装置分离碘的四氯化碳溶液
C. 用丙装置制取干燥的氨气
D. 用丁装置吸收氨气,并防止倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:

下列说法中正确的是
A. 30~40 min间该反应使用了催化剂
B. 反应方程式中的x=1,正反应为吸热反应
C. 30 min时降低温度, 40 min时升高温度
D. 8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. C6H14所有的同分异构体中主链为4个碳的只有2种
B. CH3CO18OCH2CH3在酸性条件下水解能得到CH3CH218OH
C.  的名称是2-甲基-2-乙基丙烷
的名称是2-甲基-2-乙基丙烷
D. ![]() 与
与![]() 是同一种物质
是同一种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一恒容密闭容器中充入2 mol SO2和1mol O2,在一定条件下发生反应:2SO2+O2![]() 2SO3,下列有关说法正确的是
2SO3,下列有关说法正确的是
A. 达到化学平衡时,正反应和逆反应的速率都为零
B. 当O2的浓度不变时,反应达到平衡状态
C. 当单位时间消耗a mol O2,同时消耗2a mol SO2时,反应达到平衡状态
D. 当SO2、O2、SO3的分子数比为2:1:2,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是 ( )
A.标准状况下,2.24 L CHCl3含有的分子数为0.1NA
B.0.1 mol CnH2n+2中含有的碳碳单键数为0.1nNA
C.2.8 g乙烯和丙烯的混合气体中所含碳原子为0.2NA
D.1 mol苯乙烯中含有碳碳双键数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A由三种元素组成,某兴趣小组进行了如下实验:

已知:气体甲为纯净物且只含两种元素,在标况下体积为672 mL;溶液乙为建筑行业中常用的粘合剂。
请回答下列问题:
(1)A的组成元素为________(用元素符号表示);
(2)写出气体甲与NaOH(aq)反应的离子方程式________;
(3)高温下,A与足量氯气能发生剧烈爆炸,生成三种常见化合物试写出相应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NxOy、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式_____________________,该热化学方程式的平衡常数K=______________________(用K1、K2、K3表示)
(2)直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X与溶液pH的关系如图所示。
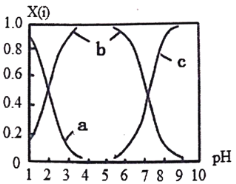
①测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是___________。
②向 NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降低,用化学平衡移动原理解释溶液pH降低的原因________________________。
(3)在一定温度下的恒容容器中,反应2N2O(g)![]() 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:
反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /(mol/L) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~40min时段,反应速率v(N2O)为___________mol/(L·min)。
②若N2O起始浓度c0为0.150 mol/L,则反应至30mn时N2O的转化率a=___________。
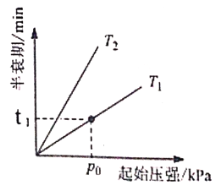
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=___________(用p0表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com