
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:2017届安徽省高三上学期第一次月考化学试卷(解析版) 题型:实验题
CaS用于制备除虫剂、发光材料等。某课题组拟用硫酸钙和焦炭在高温下反应制备硫化钙并检验产物。
(1)甲同学设计如图实验装置检验气体产物:
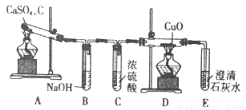
①B装置作用是 ;
②D和E装置能检验装置A的反应产物是 ;
③E装置中可能出现的现象是 。
(2)乙同学提出,根据氧化还原反应,A中的气体产物可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计方案(同一种仪器可重复使用)。
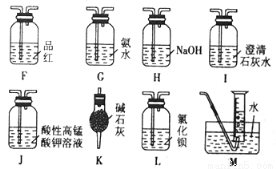
①气流从左至右,仪器连接顺序为A、F 。
②能证明有SO2的现象是 ;能证明有CO2的现象是 。
③除去SO2的离子方程式为 。
(3)经试验检验气体产物有SO2、CO、CO2且气体体积之比为1:1:2,写出A中反应的化学方程式 。
(4)利用重量法测定固体产物的质量之比,即将样品溶于足量的饱和碳酸钠溶液,过滤洗涤、干燥等。需要测定的物理量有 。(已知CaS与H2O反应生成Ca(OH)2和H2S)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上开学考化学试卷(解析版) 题型:选择题
下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是

A.反应①是加成反应 B.只有反应②是加聚反应
C.只有反应⑦是取代反应 D.反应④⑤⑥是取代反应
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上8月开学考化学试卷(解析版) 题型:选择题
常温下,不考虑混合后溶液体积的变化,下列说法错误的是( )
A.0.1mol·L-1CH3COOH溶液加水稀释后,溶液中 的值增大
的值增大
B.pH=4的CH3COOH溶液和pH=12的NaOH溶液等体积混合后恰好完全反应,则原CH3COOH溶液中CH3COOH的电离度为1%
C.amol·L-1H2C2O4溶液与2amol·L-1的NaOH溶液等体积混合后:c(C2O42-)>c(HC2O4-)>c(H2C2O4)>c(OH-)
D. 0.1mol·L-1的下列溶液中:①NH4Al(SO4)2溶液 ②NH4Cl溶液、③CH3COONH4溶液,c(NH4+)的大小顺序为①>②>③
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上8月开学考化学试卷(解析版) 题型:选择题
短周期元素 A、B、C、D、E 的原子序数依次增大;A 的一种核素在考古时常用来鉴定一些文物的年代,B的氢化物的水溶液呈碱性;C、D为金属元素,且D原子最外层电子数等于其 K 层电子数;若往 E 单质的水溶液中滴加少量紫色石蕊试液,可观察到先变红后褪色。下列说法中,正确的是( )
A. B的最高价氧化物对应的水化物的酸性比E强
B. 向D单质与沸水反应后的溶液中滴加酚酞,溶液变红
C. 某物质焰色反应呈黄色,该物质一定是含C的盐
D. B的氢化物的沸点一定高于A的氢化物
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三上8月月考理综化学试卷(解析版) 题型:填空题
某些电镀厂的酸性废水中常含有一定量的CrO42-和Cr2O72-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法,该法的工艺流程为:
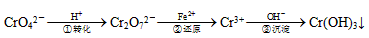
其中第①步存在平衡步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=12,该溶液显________色。
(2)写出第③步的离子反应方程式:__________。
(3)第②步中,用6mol的FeSO4·7H2O可还原________molCr2O72-离子。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法:该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)写出阳极的电极反应式___________________。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)__________________________
(7)用电镀法在铁制品上镀上一层锌,则阴极上的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三上8月月考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.标准状况下22.4LCCl4含有C—Cl键的数目为4NA
B.电解精炼铜时,若转移的电子数为NA个,则阳极减小质量为32g
C.电解58.5g熔融NaCl,标准状况能产生22.4L氯气、23.0g金属钠
D.己知N2(g)+3H2(g)  2NH3(g) △H=- 40.3kJ·mol-1 ,则在相同条件下通入6molH2和2molN2进行该反应时放出热量小于80.6kJ
2NH3(g) △H=- 40.3kJ·mol-1 ,则在相同条件下通入6molH2和2molN2进行该反应时放出热量小于80.6kJ
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期周考(8.28)化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.足量的CO2与39gNa2O2发生反应,转移的电子数为NA
B.100mL 1mol/LFeCl3溶液中,阴、阳离子总数大于0.4NA
C.用惰性电极电解硫酸铜溶液,若生成1molO2,则转移电子数为2NA
D.18g的D2O与NA个CH4具有相同的电子数
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高一上入学考试化学卷(解析版) 题型:选择题
在CuCl2溶液中加入一定量的Zn、Fe充分反应,得到一些固体,过滤,向固体中加入少量稀盐酸,有气体产生。对上述固体的叙述正确的是( )
①一定含有Zn ②一定含有Fe ③一定含有Cu ④可能含有Zn ⑤可能含有Fe ⑥可能含有Cu
A.②③④ B.①②③ C.③④⑤ D.①②⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com