
【题目】氮化硅(Si3N4)耐高温、硬度大,可用石英与焦炭在1400~1450℃的氮气中合成:3SiO2(s)+6C(s)+2N2(g)=Si3N4(s)+6CO(g)-Q(Q>0),在一定条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列问题:
(1)上述反应所涉及的属于第三周期的元素,其原子的最外层电子轨道表示式为______。其中一种元素的原子核外s电子数与p电子数相等,其原子的核外电子能量不同的有_____种。
(2)上述反应混合物中的极性分子是______,写出非极性分子的电子式________。分析用氮化硅制造轴承和发动机中耐热部件的原因是___________。
(3)该反应的平衡常数表达式为__________。可以提高二氧化硅转化率的措施是________(任写一条),该措施对平衡常数的影响为__________(填“增大”、“减小”或“保持不变”)。
(4)测得平衡时固体质量减少了5.6g,则用氮气表示的平均反应速率为__________。
【答案】![]() 3 CO
3 CO ![]() 氮化硅是原子晶体,氮原子和硅原子间的共价键决定氮化硅具有很高的硬度和熔沸点 K=
氮化硅是原子晶体,氮原子和硅原子间的共价键决定氮化硅具有很高的硬度和熔沸点 K=![]() 升高反应温度(或充入氮气) 增大(或保持不变) 0.001mol·L-1·min-1 或1×10-3 mol·L-1·min-1
升高反应温度(或充入氮气) 增大(或保持不变) 0.001mol·L-1·min-1 或1×10-3 mol·L-1·min-1
【解析】
(1)反应所涉及的属于第三周期的元素为Si元素,硅是14号元素,据此书写最外层电子轨道表示式;其中的一种元素的原子核外s电子数与p电子数相等,核外电子数排布为1s22s22p4,据此解答;
(2)反应中涉及的分子有CO和N2,根据分子的性质分析判断;氮化硅是原子晶体,据此解答;
(3)根据3SiO2(s)+6C(s)+2N2(g)=Si3N4(s)+6CO(g)结合平衡常数的概念书写表达式;该反应为吸热反应,若要提高二氧化硅转化率,需要平衡正向移动,结合平衡移动的影响因素分析解答;
(4)利用差量法计算生成参加反应氮气的质量,再根据v=![]() 计算v(N2)。
计算v(N2)。
(1)3SiO2(s)+6C(s)+2N2(g)=Si3N4(s)+6CO(g)反应所涉及的属于第三周期的元素为Si元素,硅是14号元素,最外层电子排布为3s23p2,最外层电子轨道表示式为![]() ,
,
其中的一种元素的原子核外s电子数与p电子数相等,核外电子数排布为1s22s22p4,含有3个能级,其原子的核外电子能量不同的有3种,故答案为:![]() ;3;
;3;
(2)3SiO2(s)+6C(s)+2N2(g)=Si3N4(s)+6CO(g)反应中CO属于极性分子,氮气为非极性分子,氮气分子中N原子之间形成3对共用电子对,电子式为![]() ;氮化硅是原子晶体,具有很高的硬度和熔沸点,可以制造发动机中耐热部件,故答案为:CO;
;氮化硅是原子晶体,具有很高的硬度和熔沸点,可以制造发动机中耐热部件,故答案为:CO;![]() ;氮化硅是原子晶体,具有很高的硬度和熔沸点;
;氮化硅是原子晶体,具有很高的硬度和熔沸点;
(3)3SiO2(s)+6C(s)+2N2(g)=Si3N4(s)+6CO(g),反应的平衡常数表达式K=![]() ;该反应为吸热反应,若要提高二氧化硅转化率,需要平衡正向移动,可以采取的措施有升高反应温度、充入氮气等;升高反应温度,配合正向移动,平衡常数增大,若采取的措施是充入氮气,尽管平衡移动,但温度不变,平衡常数保持不变,故答案为:K=
;该反应为吸热反应,若要提高二氧化硅转化率,需要平衡正向移动,可以采取的措施有升高反应温度、充入氮气等;升高反应温度,配合正向移动,平衡常数增大,若采取的措施是充入氮气,尽管平衡移动,但温度不变,平衡常数保持不变,故答案为:K=![]() ;升高反应温度(或充入氮气);增大(或保持不变);
;升高反应温度(或充入氮气);增大(或保持不变);
(4)设反应的氮气的物质的量为x,
3SiO2(s)+6C(s)+2N2(g)Si3N4(s)+6CO(g) 固体质量减少
2mol 112g
x 5.6g
则![]() =
=![]() ,解得:x=0.1mol,则v(N
,解得:x=0.1mol,则v(N![]() =0.001mol/(L·min),故答案为:0.001mol/(L·min)。
=0.001mol/(L·min),故答案为:0.001mol/(L·min)。


科目:高中化学 来源: 题型:
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 1.9gH3O+中含质子总数为NA
B. 体积均为22.4L(标准状况)的乙烯和乙酸含氢原子数均为4NA
C. 1L0.1mol·L-1NH4A1(SO4)2溶液中阳离子总数小于0.2NA
D. 当反应MgO+C+Cl2![]() MgCl2+CO中断裂2 mol Cl-Cl键时,转移电子总数为4NA
MgCl2+CO中断裂2 mol Cl-Cl键时,转移电子总数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有K2SO4、MgSO4、CaCl2的KCl固体提纯,并制得纯净的KCl晶体,某同学设计如下实验方案,请回答下列问题:

(1)操作⑤⑥的名称依次为___、___。
(2)操作②、③加入溶液后,发生反应的离子方程式分别为___、___。
(3)该同学设计的实验方案___(填“严密”或“不严密”),理由是___,该步骤所加试剂应该是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备乙酸丁酯的装置如图所示,下列分析错误的是

A. 加入过量乙酸可以提高丁醇的转化率
B. 提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
C. 导气管a起到冷凝回流的作用
D. 制乙酸丁酯的反应温度超过100℃不能用水浴加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,正确的是( )
A. 少量金属钠密封保存在水中
B. 新制的氯水通常保存在无色试剂瓶中
C. 氢氧化钠溶液保存在有玻璃塞的玻璃试剂瓶中
D. 氢氟酸保存在塑料瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.1 mol·L-1的一元酸HA溶液中加入0.1 mol · L-1 NaOH溶液,HA和A- 的物质的量分数(α)随溶液pH变化的关系如图所示,下列说法正确的是:
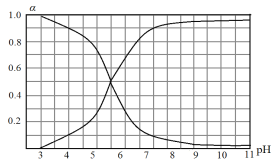
A. pH<5.5时,c(HA)<c(A-)
B. pH>8时,c(Na+)+c(H+)>c(A-)
C. pH=7时,c(HA)>c(A-)>c(OH-)=c(H+)
D. pH=5时α(HA)与α(Aˉ)之和比pH=9时α(HA)与α(Aˉ)之和大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )
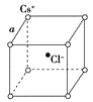
A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com