
| A. | 冰的密度小于液态水 | B. | 氨气易液化 | ||
| C. | HF的沸点高于HI | D. | 有机物普遍存在同分异构现象 |
分析 N、O、F元素的电负性较强,对应的氢化物可形成氢键,氢键是一种较强的分子间作用力,是由电负性强的原子(如F,O,N)对氢原子的吸引力产生的,能够影响物质的熔点、沸点、密度等,以此解答该题.
解答 解:A.冰中含有氢键,其体积变大,则质量不变时冰的密度比液态水的密度小,故A不选;
B.氨气分子之间能形成氢键,沸点高,因此易液化,故B不选;
C.HF分子之间能形成氢键,沸点高于HI,故C不选;
D.有机物普遍存在同分异构现象,与碳原子的成键方式等有关,与氢键无关,且很多有机物中不存在氢键,故D选.
故选D.
点评 本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 50℃时,测定某NaNO2溶液的pH=8,则溶液中c(Na+)-c(NO2-)=9.9×10-7mol•L-1 | |||||||||
| B. | NaHSO3水溶液中存在关系:c(H2SO3)+c(H+)=c(OH-)+c(SO32-)+c(HSO3-) | |||||||||
| C. | 一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
| |||||||||
| D. | 已知25℃时,有关弱电解质的电离平衡常数:HCN:Ka=4.9×10-10;H2CO3:Ka1=4.3×10-7Ka2=5.6×10-11.则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2=2HCN+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;D元素在元素周期表中的位置为第四周期第Ⅷ族
;D元素在元素周期表中的位置为第四周期第Ⅷ族查看答案和解析>>
科目:高中化学 来源: 题型:选择题
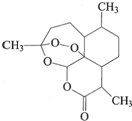 中国药学家屠呦呦获得2015年诺贝尔生理医学奖.她发现了青蒿素--一种用于治疗疟疾的药物,挽救了全球数百万人的生命.青蒿素的结构如图所示.下列有关青蒿素的说法不正确的是( )
中国药学家屠呦呦获得2015年诺贝尔生理医学奖.她发现了青蒿素--一种用于治疗疟疾的药物,挽救了全球数百万人的生命.青蒿素的结构如图所示.下列有关青蒿素的说法不正确的是( )| A. | 分子式为C15H22O5 | |
| B. | 易溶于乙醚等有机溶剂 | |
| C. | 可发生取代反应,不能发生氧化反应 | |
| D. | 在强酸或强碱性溶液中不能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Cu的晶体的配位数为12 | |
| B. | 金属键是金属阳离子与自由电子间的相互作用 | |
| C. | 金属的延展性可以用电子气理论解释 | |
| D. | 金属Mg、Zn、Ti都是六方最密堆积,空间利用率是68% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 节日焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 生活中常用的塑料制品及橡胶制品都为高分子材料 | |
| C. | 向牛奶中加入果汁会产生沉淀,这是因为酸碱发生了中和反应 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| ① | 160 | $\frac{2}{3}$ | 1 |
| ② | x | $\frac{2}{3}$ | 5 |
| ③ | 260 | y | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com