
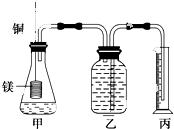
 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:分析 Ⅰ(2)根据酸式滴定管和碱式滴定管的使用要求以及精确度来选择;
(5)比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化;
Ⅱ(1)根据先冷却、再调整高度相等、最后读出量筒中体积的顺序排列即可;
(2)读数时要保持左右气体压强相等,以减少误差;
(3)从影响化学反应速率的因素来分析;
(4)根据镁与铜易形成原电池,加快反应速率,干扰实验测定分析.
解答 解:Ⅰ.(2)题中要求酸的体积10.00 mL较精确,应选酸式滴定管,如用碱式滴定管会腐蚀橡胶管,
故答案为:酸式滴定管;
(5)比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化,
故答案为:反应所需时间;
Ⅱ.(1)应该先将溶液冷却到室温,然后使乙、丙中液面相平,最后读出量筒中溶液体积,所以正确顺序为:
故答案为:②①③;
(2)读数时要保持左右气体压强相等,以减少误差,所以应该将量筒缓缓向下移动,使乙、丙中液面相平,
故答案为:将丙向下移动;
(3)影响化学反应速率的因素有浓度、温度、压强等,本题为浓度不同,
故答案为:H+浓度不同;
(4)镁与铜易形成原电池,加快反应速率,干扰实验测定,所以铜丝不与酸接触,
故答案为:镁与铜易形成原电池,加快反应速率,干扰实验的测定.
点评 本题考查了探究影响化学反应速率的因素的方法,涉及了配制一定浓度的溶液的仪器选用、化学基本所以实验操作等知识,题目难度中等,注意掌握影响化学反应速率的因素.


科目:高中化学 来源: 题型:解答题
| 序号 | 反应 温度/℃ | c(H2O2)/ mol•L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
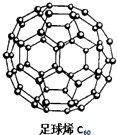 C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )
C60可用作储存氢气的材料,结构如右图所示.继C60后,科学家又合成了Si60、N60,三种物质结构相似.下列有关说法正确的是( )| A. | C60、Si60、N60都属于新型化合物 | |
| B. | C60、Si60、N60分子内共用电子对数目相同 | |
| C. | 由于N-N键能小于N≡N,故N60的稳定性弱于N2 | |
| D. | 由于C-C键长小于Si-Si键,所以C60熔沸点低于Si60 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa | B. | CH3COOH和CH3COONa | ||
| C. | CH3COONa和NaOH | D. | CH3COOH和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
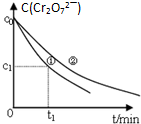 某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始c(H+) | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 1.0×10-4 | 60 | 10 | 30 |
| ② | 1.0×10-5 | 60 | 10 | 30 |
| ③ | 1.0×10-5 | 60 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比试验. | 反应进行相同时间后,若溶液中的Cr2O72-浓度大于实验①中Cr2O72-浓度,则假设一成立;若两溶液中的Cr2O72-浓度相同,则假设一不成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
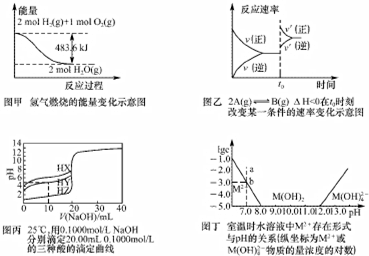
| A. | 由图甲可知:H2的燃烧热为241.8kJ/mol | |
| B. | 由图乙可知:t0时刻改变的条件是增大压强或者升高温度 | |
| C. | 由图丙可知:将上述HX、HY、HZ溶液等体积混合,用NaOH溶液滴定至HX恰好完全反应时,溶液中的离子浓度:c(Z-)>c(X-)>c(Y-)>c(OH-)>c(H+) | |
| D. | 由图丁可知:室温时M(OH)2(s)的溶度积常数为1.0×10-17 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com