
用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( )
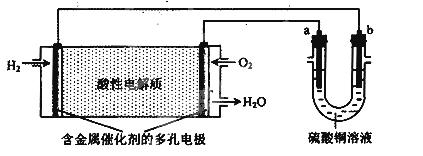
A. a为负极,b为正极
B.若a极是铁,b极是铜,b极逐渐溶解,a极上有铜析出
C.若a、b极都是石墨,在相同条件下,理论上a极产生的气体与电池中消耗的O2体积相等
D.若电解精炼粗铜时,b极是粗铜,a极是纯铜
【知识点】原电池和电解池原理
【答案解析】C 解析:A、氢氧燃料电池中,氢气做负极,失电子,氧气做正极,得电子,所以a电极是阳极,b电极是阴极,故A错误;B.若a极是铁,b极是铜,阳极铁失电子,溶解,b电极上铜析出,故B错误;C.若a、b极都是石墨,a电极上氢氧根放电:4OH--4e-=2H2O+O2↑,电池中消耗氧气的电极反应式:O2+2H2O+4e-=4OH-,所以,在相同条件下,理论上a极产生的气体与电池中消耗的O2体积相等,故C正确;D、若电解精炼粗铜时,b极是纯铜,a极是粗铜,故D错误;
故答案选C
【思路点拨】本题考查原电池和电解池的原理,题目难度中等,注意正负极的判断与电极反应式的书写。


科目:高中化学 来源: 题型:
某工厂用含氧化铁75%(质量分数)的赤铁矿石和一氧化碳为原料炼铁(假设杂质不参加反应)。在炼铁过程中,为了使赤铁矿石充分反应,通入了过量的一氧化碳。这些过量的一氧化碳也可看成是“不参加反应的杂质”。若反应后排出的气体中一氧化碳的质量分数为10%。试计算:
(1)氧化铁(Fe2O3)的相对分子质量。
(2)该炼铁过程中所用原料赤铁矿石和一氧化碳的质量比。
(3)为了得到生铁,炼铁过程需要除去矿石中的部分杂质。如果不除去杂质,反应后所得到的产品中杂质的质量分数将会是多少?(结果可用分式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学用沉淀法测定Na2CO3和NaOH混合物中NaOH的质量分数,有关叙述如下。①可以使用MgCl2溶液作沉淀剂,使OH-转化为氢氧化镁沉淀 ②检验CO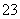 是否完全沉淀的操作方法是取上层清液,向其中继续滴加沉淀剂溶液,观察是否有沉淀继续生成 ③用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是能提高实验结果的准确度 ④用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是CO
是否完全沉淀的操作方法是取上层清液,向其中继续滴加沉淀剂溶液,观察是否有沉淀继续生成 ③用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是能提高实验结果的准确度 ④用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是CO 能100%转化为沉淀。其中正确的叙述是( )
能100%转化为沉淀。其中正确的叙述是( )
A.①② B.②③ C.①③④ D.都正确
查看答案和解析>>
科目:高中化学 来源: 题型:
A~X七种有机物间转化关系如图所示。其中气体A在标准状况下密度为1.25 g/L,且碳元素的质量分数为85.7%;E普遍存在于许多食物中(如花生、菠菜等);F分子中含有一个六元环,晶体X中仅含C、H、O三种元素,且原子个数比为1:3:3。试回答下列问题:
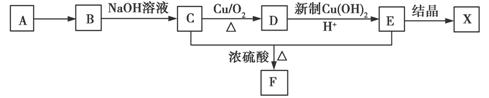
(1)C的结构简式为______________;晶体X的化学式为________________________。
(2)下列转化过程涉及的有机化学反应中,属于取代反应的是________(填序号)。
①A→B ②B→C ③C→D ④D→E ⑤C、E→F
(3)写出D与新制Cu(OH)2悬浊液反应的方程式:_____________________________;
写出C与E生成高分子化合物的化学方程式:____________________________。
(4)简述确定有机物B中官能团的实验方法:________________________________________
_____________________________________________________________________________。
(5)有机物W是F的同系物,具有和F相似的结构,分子组成比F多四个碳原子,也含有六元环,其1H-NMR谱图上只有一个峰,写出一种符合上述条件的W的结构简式:______________________。
(6)有机物Y是一种重要有机化工原料,可制备调香剂、皮肤创伤的愈合剂和某些药品(如头孢)等,Y的分子组成比E少一个氧原子,Y有两种不同的含氧官能团。通过电解方法可由E制取Y,电解槽中阳极通常用石墨,阴极用复合膜电极,采用阳离子交换膜,电解质溶液为饱和E与H2SO4的混合溶液。写出电解槽中阴极的电极反应式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质)。以这种矿石为原料制取硫酸铜的工艺流程如下图:
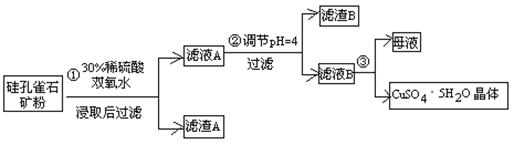
请回答下列问题:
⑴完成步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式
CuSiO3·2H2O+H2SO4=CuSO4 +________+H2O;
⑵步骤②调节溶液pH选用的最佳试剂是__________________
A. CuO B. MgO C. FeCO3 D NH3·H2O
⑶有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
由上表可知:当溶液pH=4时,不能完全除去的离子是________。
⑷滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4·5H2O晶体。某同学认为上述操作会伴有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中C(Al3+)=2.25mol·L-1,Ksp[Al(OH)3]=3.2×10-34) ________(填“正确”或“错误”)。
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
 Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。[]
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。[]
 Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相)R2Cu
(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是____________________(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是_____________ 。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
从下列事实,找出不能用勒沙特列原理解释的是
A.在溴水中存在如下平衡: ,当加入NaOH溶液后颜色变浅
,当加入NaOH溶液后颜色变浅
B.对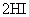

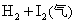 平衡体系增加压强使颜色变深
平衡体系增加压强使颜色变深
C.反应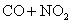

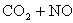 升高温度使平衡向逆方向移动
升高温度使平衡向逆方向移动
D.合成氨反应: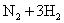

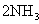 ,为使氨的产率提高,理论上应采取低温高压的措施
,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
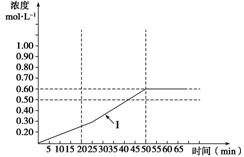
将1.00 mol二氧化硫和1.00 mol氧气通入1.00 L的密闭容器中,分别在500 K,600 K,700 K三个不同的温度下进行2SO2+O2 2SO3反应,反应过程中SO3浓度随时间的变化如下面表格所示:
2SO3反应,反应过程中SO3浓度随时间的变化如下面表格所示:
表一:500 K
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol·L-1) | 0 | 0.10 | 0.15 | 0.20 | 0.25 | 0.30 |
| 时间 | 30 | 35 | 40 | 45 | 50 | 55 |
| SO3浓度(mol·L-1) | 0.35 | 0.40 | 0.50 | 0.55 | 0.60 | 0.60 |
表二:600 K
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol·L-1) | 0 | 0.20 | 0.30 | 0.40 | 0.50 | 0.50 |
表三:700 K
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol·L-1) | 0 | 0.25 | 0.35 | 0.35 | 0.35 | 0.35 |
(1)从上面三个表的数据可以判断该反应是__________反应(填“吸热”或“放热”),利用表一计算0~40 min内用SO2表示该反应的化学反应速率v(SO2)=__________mol·L-1·min-1。
(2)对该反应,下面的说法正确的是__________。
A.当容器中的压强不再变化时,该反应就达到平衡
B.达到平衡时v正(SO2)=v逆(SO3)
C.平衡时c(SO2)=c(SO3)
D.当由500 K平衡状态时升高温度至600 K时,重新达到平衡状态时,容器的压强减小
(3)从上面三个表的数据,温度对该反应的反应速率和平衡移动的影响是_____________________________________________________________________。
(4)计算在600 K时的平衡常数(写出计算过程,最后结果取两位有效数字)。
(5)下图曲线(Ⅰ)是在500 K时SO3浓度的变化曲线,请你在图中画出在550 K进行上述反应的曲线,并标明曲线(Ⅱ)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com