
| A. | NaCl | B. | H2SO4 | C. | AgNO3 | D. | Na2SO4 |
分析 一定温度下,pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,说明溶液碱性增强,
A.电解氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,最后得到的溶液中溶质含有NaOH;
B.电解稀硫酸溶液时,阳极上氢氧根离子放电、阴极上氢离子放电,实质上是电解水,溶液浓度增大;
C.电解硝酸银溶液时,阴极上银离子放电、阳极上氢氧根离子放电,所以最后得到的溶液中含有硝酸,溶液酸性增强;
D.电解硫酸钠溶液,阳极上氢氧根离子放电、阴极上氢离子放电,实质上是电解水,硫酸钠浓度增大,但溶液呈中性.
解答 解:一定温度下,pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,说明溶液碱性增强,
A.电解氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,最后溶液中溶质有NaOH,碱性增强,pH增大,符合条件,故A正确;
B.电解稀硫酸溶液时,阳极上氢氧根离子放电、阴极上氢离子放电,实质上是电解水,溶质的物质的量不变但溶液体积减小,所以硫酸浓度增大,溶液的pH减小,故B错误;
C.如果电解硝酸银溶液,阴极上银离子放电、阳极上氢氧根离子放电,所以最后得到的溶液中含有硝酸,溶液酸性增强,pH减小,不符合条件,故C错误;
D.电解硫酸钠溶液,阳极上氢氧根离子放电、阴极上氢离子放电,实质上是电解水,硫酸钠浓度增大,但硫酸钠是强碱强酸盐,溶液呈中性,所以电解后溶液pH不变,故D错误;
故选A.
点评 本题考查电解原理,明确离子放电顺序是解本题关键,结合溶液酸碱性变化确定电解电解质溶液,题目难度不大.


科目:高中化学 来源: 题型:选择题
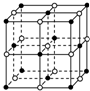 食盐晶体是由钠离子(图中的“
食盐晶体是由钠离子(图中的“ ”)和氯离子(图中的“○”)组成的,且均为等距离的交错排列.已知食盐的密度是2.2g•cm-3,阿伏加德罗常数6.02×1023 mol-1.在食盐晶体中两个距离最近的钠离子中心间的距离最接近于( )
”)和氯离子(图中的“○”)组成的,且均为等距离的交错排列.已知食盐的密度是2.2g•cm-3,阿伏加德罗常数6.02×1023 mol-1.在食盐晶体中两个距离最近的钠离子中心间的距离最接近于( )| A. | 3.0×10-8 cm | B. | 3.5×10-8 cm | C. | 4.0×10-8 cm | D. | 5.0×10-8 cm |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 | |
| B. | 反应②中,1mol葡萄糖可生成3mol乙醇 | |
| C. | 将在空气中灼绕后的铜丝趁热插入乙醇中可得到乙酸 | |
| D. | 反应①中,(C6H10O5)n可表示淀粉或纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
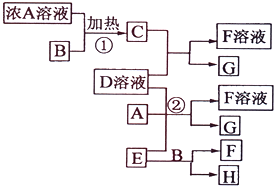 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时,NaNO2溶液的pH=8,则该溶液中c(Na+)-c(NO2-)=9.9×10-7mol•L-1 | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性的离子方程式为:H++SO42++Ba2++OH-═BaSO4↓+H2O | |
| C. | 常温下物质的量浓度相等的下列四种溶液:①NH4HSO4;②CH3COONH4;③NH4Cl;④NH4Fe(SO4)2,四种溶液中c(NH4+)比较:②>①>④>③ | |
| D. | 常温下$\frac{Kw}{c({H}^{+})}$=1×10-10mol•L-1的溶液:Na+、K+、SiO32-、NO3-可以常量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
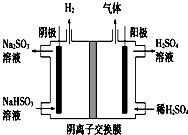 工业上用Na2SO3吸收尾气中的SO2,再用如图装置电解(惰性电极)NaHSO3制取H2SO4,阴极电极反应式2H++2e-=H2↑,阳极区逸出气体的成分为O2 SO2(填化学式).
工业上用Na2SO3吸收尾气中的SO2,再用如图装置电解(惰性电极)NaHSO3制取H2SO4,阴极电极反应式2H++2e-=H2↑,阳极区逸出气体的成分为O2 SO2(填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
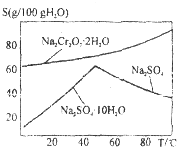 工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:
工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O)的主要反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过早判断反应终点 | |
| B. | 在测定铁皮的面积时测得面积比铁皮的实际面积大 | |
| C. | 过迟判断反应终点 | |
| D. | 锌在酸中溶解后,铁皮未烘干就去称重 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com