
| A. | CH2O与C2H4O2 | B. | C4H10与C4H6O | C. | CF2Cl2与C2F2Cl2 | D. | C4H10与C3H6 |
分析 A.CH2O只能是甲醛,C2H4O2可以是乙酸或甲酸甲酯;
B.C4H10只能是烷烃,根据碳链异构确定同分异构体,C4H6O可以是烯醛或烯酮或环酮等;
C.根据甲烷是正四面体来解答;
D.C4H10只能是烷烃,根据碳链异构确定同分异构体,C3H6可以是烯烃或环烷烃;
解答 解:A.CH2O只能是甲醛,C2H4O2可以是乙酸或甲酸甲酯,同分异构体的数目不同,故A错误;
B.丁烷(C4H10)有2种同分异构体:正丁烷和异丁烷,C4H6O作为烯醛有:CH2=CHCH2CHO、CH3CH=CHCHO CH2=C(CH3)CHO,所以同分异构体的数目不同,故B错误;
C.根据甲烷是正四面体,CF2Cl2与C2F2Cl2是同分物质,不存在同分异构体,故C错误;
D.丁烷(C4H10)有2种同分异构体:正丁烷和异丁烷,C3H6只能是丙烯或环丙烷,所以同分异构体的数目相同,故D正确;
故选D.
点评 本题主要考查了同分异构体数目的判断,可通过同分异构体的类型进行简单判断,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 32gO2所含的氧原子数目为NA | |
| B. | 标准状况下,22.4L水中所含的水分子数目为NA | |
| C. | 1mol•L-1Na2SO4溶液中含有的钠离子数目为2NA | |
| D. | 1molMg变为Mg2+时失去电子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭去除冰箱中的异味 | |
| B. | 用热碱水清除炊具上残留的油污 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| D. | 用含硅胶、铁粉的透气小袋与食品一起密封包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
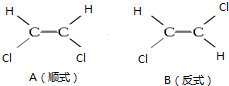 1,2一二氯乙烯有如图两种结构.
1,2一二氯乙烯有如图两种结构.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | a | b | c |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某研究小组探究:
某研究小组探究:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
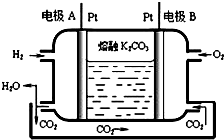 运用所学化学原理,解决下列问题:
运用所学化学原理,解决下列问题:| 温度/ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com