
分析 Fe和Fe2O3的混合物与稀H2SO4反应,Fe和Fe2O3均无剩余,且有H2生成,说明反应生成FeSO4,再加入NaOH溶液,使FeSO4全部转化为Fe(OH)2沉淀,反应后溶液成分为Na2SO4,根据硫酸根守恒有n(H2SO4)=n(Na2SO4),根据钠离子守恒有n(Na2SO4)=$\frac{1}{2}$n(NaOH),进而计算硫酸的物质的量浓度.
解答 解:Fe和Fe2O3的混合物与稀H2SO4反应,Fe和Fe2O3均无剩余,且有H2生成,说明反应生成FeSO4,再加入NaOH溶液,使FeSO4全部转化为Fe(OH)2沉淀,反应后溶液成分为Na2SO4,
根据硫酸根守恒,则n(H2SO4)=n(Na2SO4),根据钠离子守恒,则n(Na2SO4)=$\frac{1}{2}$n(NaOH),则有:n(H2SO4)=n(Na2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×3mol/L×0.15L=0.225mol,故c(H2SO4)=$\frac{0.225mol}{0.2L}$=1.125mol/L,
故答案为:1.125mol/L.
点评 本题考查混合物的有关,难度中等,清楚发生的反应是关键,注意利用守恒方法进行的计算,侧重考查学生分析计算能力.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题

| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

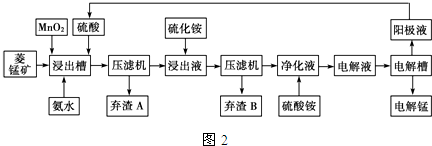
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO2→ClO2+Cl2+H2O(未配平),1 mol HClO2分解时转移电子的物质的量为1 mol | |
| B. | 标准状况下,14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA | |
| C. | 与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+ | |
| D. | 在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO3+2CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ | |
| B. | 硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3•H2O+H2O | |
| C. | 碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3•H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:Y>Z>X | |
| B. | 含Y元素的盐溶液有的显酸性,有的显碱性 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | X与R的核电荷数相差24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com