
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是
A.N5+ 离子中含有36个电子 B.H2与H3属于同素异形体
C.C60的摩尔质量为720 D.O2与O4属于同位素
科目:高中化学 来源: 题型:
聚四氟乙烯的耐热性和化学性质的稳定性都超过了其他材料,号称“塑料王”。在工业生产上有广泛的应用,其合成路线如图所示:
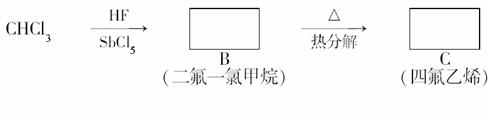
(1)在方框内填写合适的有机物的结构简式。(2)写出下列反应的化学方程式 :
:
B―→C________________________________________________________________________;
C―→D________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
重庆汽车研究所国家燃气汽车工程技术研究中心经过多年攻关,早已完成了国内第一辆达到欧洲Ⅲ号排放标准的天然气单一燃料汽车的研制。时隔一年,在此基础上, 又一举拿下了汽油——天然气双燃料汽车,并且达到了欧洲Ⅲ号排放标准,得到了政府的大力支持并被推广使用。
又一举拿下了汽油——天然气双燃料汽车,并且达到了欧洲Ⅲ号排放标准,得到了政府的大力支持并被推广使用。
(1)天然气的主要成分为 ,是 在隔绝空气条件下,经微生物发酵作用形成的,因此,天然气中贮藏的化学能最终是来自于
(2)从石油中获得更多轻质燃油的方法是______________________。
(3)利用天然气可以制高档墨水和橡胶用的炭黑,同时得到合成氨工业所需H2,该反应的化学方程式为 ,天然气成分两分子偶联可以得到乙烯,在一定程度上缓解了石油危机,该反应的化学方程式为________________________________________________。
(4)政府推广使用燃气汽车的主要目的是 (填序号)。A.延长发动机使用寿命
B.促进西部经济发展
C.减少污染
D.提高能源利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA是阿伏加德罗常数的值,下列说法正确的是
A.1 L1mol·L-1的NaClO溶液中含有ClO-的数目为NA
B.60g 二氧化硅含有的共价键数为2NA
C.7.8g 钾与100mL 1mol·L-1盐酸充分反应生成气体分子数为0.1NA
D.标准状况下,7.1g 氯气与足量的石灰乳充分反应,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g) CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
① 一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为__________。(填“<”、“>”“=”)

② 100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,反应达平衡的标志是: 。
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4)= v逆(H2)如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K =
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为 。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗的标准状况下的CO 224 mL,则溶液的pH = 。(不考虑溶液体积的变化)
(4)氢氧燃料电池的三大优点是: 、 、能连续工作。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的化学方程式或离子方程式正确的是
A.以MnO2为原料制得的MnCl2溶液中常含有Cu2+等金属离子,通常添加难溶电解质MnS使这些离子形成硫化物沉淀而除去:Cu2+ + S2-=CuS↓
B.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2OH- = SiO32- + H2O
C.金属钠在空气中放置表面会很快失去金属光泽:2Na + O2 = Na2O2
D.向硫酸亚铁铵[(NH4)2Fe(SO4) 2·6H2O]的稀溶液中加入足量Ba(OH)2稀溶液:NH4+ + Fe2+ + SO42-+ Ba2+ +3OH- = BaSO4↓+ Fe(OH)2↓+ NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物G的合成路线如下:
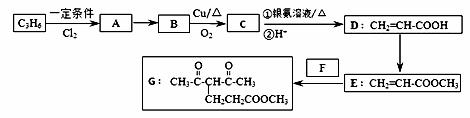
(1)D中含氧官能团的名称为 ,1 mol G发生加成反应最多消耗 mol H2 。
(2)除掉E中含有少量D的试剂和分离方法分别是 , ;
(3)下列说法正确的是 (填字母序号)。
a.A易溶于水
b.只用溴水即可确定C中含有碳碳双键
c.E经加聚、碱性条件下水解,所得高聚物可做具有高吸水性能的树脂
d.E是CH2=CHCOOCH2CH3的同系物
(4)写出A→B的化学反应方程式 ;
写出C和银氨溶液反应的离子方程式 。
(5)反应E + F→ G属于下列麦克尔加成反应类型,则F的结构简式为 。
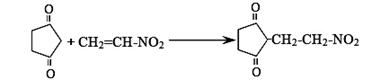

(6)比G少2个氢原子的物质具有下列性质:①遇FeCl3溶液显紫色;②苯环上的一氯取代物只有一种;③1mol物质最多可消耗2mol Na和1mol NaOH。任写一种该物质的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用0.01 mol·L-1NaOH溶液完全中和pH=3的下列溶液各
100 mL需NaOH溶液体积最大的是( )
A.盐酸 B.硫酸 C.高氯酸 D.醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NaHSO4在水中的电离方程式为:NaHSO4====Na++H++S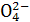 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。对于该溶液,下列叙述中不正确的是( )
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。对于该溶液,下列叙述中不正确的是( )
A.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好是中性
B.水电离出来的c(H+)=1×10-10mol·L-1
C.c(H+)=c(OH-)+c(S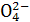 )
)
D.该温度高于25℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com