
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变。
不变。
D. 向盐酸中加入氨水至中性,溶液中![]() >1
>1
科目:高中化学 来源: 题型:
【题目】下列关于说法正确的是
A. HCl和NaOH反应的中和热为57.3kJ/mol,H2SO4和Ba(OH)2反应的中和热也为57.3kJ/mol
B. 已知C2H5OH(l)的燃烧热是1366.8kUmol,则C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)反应的△H=-1366.8kJ/mol
C. 一定温度和压强下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ.则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ/mol
2NH3(g) △H=-38.6 kJ/mol
D. 一定条件下2SO2(g)+O2(g)![]() 2SO3(g)△H1 2SO2(g)+O2(g)
2SO3(g)△H1 2SO2(g)+O2(g)![]() 2SO3(l)△H2则△H1>△H2
2SO3(l)△H2则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、N、Na、Al、Ti等元素在能源、材料等领域应用广泛。回答下列问题:
(一)氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示,为长方体。
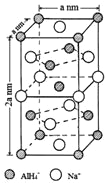
(1)基态Ti原子的价电子排布图为_________,L能层中电子云的形状有_______种。
(2)AlCl3在178℃时升华,属于__________晶体,其蒸气的相对分子质量约为267,蒸气分子的结构式为___________(标明配位键),其中Al的轨道杂化方式为____________。
(3)写出与AlH4-空间构型相同的一种分子和一种离子_________(填化学式)。
(4)NaAlH4晶体中,与AlH4-紧邻且等距的Na+有__________个;NaAlH4晶体的密度为_____________g·cm-3(用含a的代数式表示)。
(二)叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。
(1)写出与N3-属于等电子体的一种分子__________(填分子式)。
(2)氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是___(填标号)
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为:

下列说法不正确的是
A. HO(CH2)4OH的沸点高于CH3CH2CH2CH3
B. 高分子材料PU在强酸、强碱中能稳定存在
C. 合成PU的两种单体的核磁共振氢谱中均有3个吸收峰
D. 以1,3-丁二烯为原料,可合成HO(CH2)4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水质量是关系人类健康的重要问题。
(1)在我国,一些贫困山区的农民至今还饮用井水,但暴雨过后井水混浊,无法饮用。为了能让暴雨过后井水尽快变的澄清,你会建议他们最好向井水中投入下列中的___(填序号)。
A.NaCl B.Na2CO3 C.Kal(SO4)2·12H2O D.CuSO4
(2)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为:____________________________
(3)写出工业上制取漂白粉的化学方程式:__________________
(4)臭氧,也称作超氧,可以替代氯气给自来水消毒,即提高了消毒效率且安全无副作用,臭氧的分子式为O3,该物质和次氯酸均可以做漂白剂,二者的漂白原理是:_______________。
(5)某化学活动小组设计实验(装置如图)验证氯、溴、碘及其化合物的有关物质。在硬质玻璃管中的A、B、C三处依次放置湿润的蓝色石蕊试纸、浸有NaBr溶液的棉球、浸有淀粉-KI溶液的棉球(如图所示),由左端通入足量氯气,回答下列问题:
![]()
①观察到的现象
A:__________________;B:__________________;C:__________________
②由上述现象得出的结论氧化性:Cl2 > Br2 > I2,你认为正确吗,为什么? ______________;___________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。有效“减碳”的手段之一是节能。
I.下列制氢方法最节能的是______(填字母序号)。
A.电解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O![]() CO+3H2
CO+3H2
II.科学家提出“绿色自由”构想,把空气中的CO2使用合适的催化剂可转化为可再生能源甲醇(CH3OH)。该反应的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是______ (填字母序号)。
A.CO2和CH3OH的浓度相等 B.3v正(H2)=v逆(H2O)
C.容器内压强保持不变 D.H2的百分含量保持不变
E. 容器中混合气体的密度保持不变
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应。反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如右图,则上述CO2转化为甲醇的反应的△H______0(填“>”、“<”或“=”)。

(3) 300℃时,将CO2和H2按1:3的体积比充入某密闭容器中,CO2的平衡转化率(α)与体系总压强(P)的关系如右图所示。回答问题:

①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是_______(填字母序号)。
A.CO2的浓度减小 B.正反应速率增大,逆反应速率增大
C.甲醇的物质的量增加 D.重新平衡时n(H2)/n(CH3OH)增大
②B点平衡混合气体的平均摩尔质量为________(保留一位小数)。
(4)甲醇—空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如图,该燃料电池的电池反应式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l),则负极的电极反应式为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3Cl2+6KOH![]() KClO3+5KCl+3H2O的反应中,下列说法不正确的是( )
KClO3+5KCl+3H2O的反应中,下列说法不正确的是( )
A. KCl是还原产物,KClO3是氧化产物
B. KOH在该反应中体现碱性和还原性
C. 反应中每消耗3 mol Cl2,转移电子数为5NA
D. 被还原的氯气的物质的量是被氧化的氯气的物质的量的5倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某有机物 的性质叙述正确的是
的性质叙述正确的是
A. 1mol该有机物最多可以与6mol H2发生反应
B. 1mol该有机物最多可以与3molNa发生反应
C. 1mol该有机物最多可以与3mol NaOH发生反应
D. 1mol该有机物最多可以与2mol NaHCO3发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com