
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq)。下列有关叙述中正确的是
A.该反应的平衡常数K=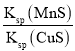
B.MnS的Ksp小于CuS的Ksp
C.达到平衡时c(Mn2+)=c(Cu2+)
D.向溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Mn2+)保持不变
科目:高中化学 来源: 题型:
【题目】I.常温下,HNO2电离反应的平衡常数值为2.6×10-4。NaNO2是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
(1)某活动小组同学设计实验方案鉴别 NaCl溶液和NaNO2溶液,请填写下列表格。
选用药品 | 实验现象 | 利用NaNO2的性质 |
①酚酞试液 | ____________ | ____________ |
②淀粉-KI试纸 | ____________ | ____________ |
(2)亚硝酸钠有毒,不能随意排放,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,则该气体为____________(填化学式)。
II.活动小组同学采用如下装置制备并测定所得固体中亚硝酸钠(NaNO2)的质量分数(装置可重复使用,部分夹持仪器已省略)。
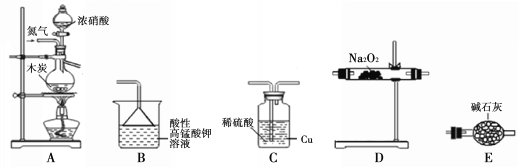
已知: ①2NO + Na2O2 =2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使
酸性高锰酸钾溶液褪色。
(1)实验装置的连接顺序为____________;
(2)C瓶内发生反应的离子方程式为____________。
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液进行滴定,实验所得数据如下表。
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
①第一组实验数据出现较明显异常,造成异常的原因可能是__________(填字母序号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为____________。
(4)设计实验,比较0.1mol·L-1NaNO2溶液中NO2-的水解程度和0.1mol·L-1HNO2溶液中HNO2电离程度的相对大小_______(简要说明实验步骤、现象和结论,仪器和药品自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最早制得和使用铜、锌的国家,铜、锌及其化合物在日生产和生活中有着广泛的应用。回答下列问题:
(1)Cu在元素周期表中位于 _____(选填“s” “p” “d”或“ds” )区。在高温下CuO能分解生成Cu2O,试从原子结构角度解释其原因______________。
(2)Cu2+能与吡咯(![]() )的阴离子(
)的阴离子(![]() )形成双吡咯铜。
)形成双吡咯铜。
①![]() 中C和N原子的杂化均为________,1mol
中C和N原子的杂化均为________,1mol![]() 含有_____molσ键。
含有_____molσ键。
②双吡咯铜Cu(![]() )2中含有的化学键有_____(填编号)。
)2中含有的化学键有_____(填编号)。
A 金属键 B 极性键 C 非极性键 D 配位键 E 氢键
③噻吩(![]() )的沸点为84℃,吡咯(
)的沸点为84℃,吡咯( ![]() )的沸点在129 ~131℃之间,吡咯沸点较高,其原因是________。
)的沸点在129 ~131℃之间,吡咯沸点较高,其原因是________。
④分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成的大
表示,其中m代表参与形成的大![]() 键原子数,n 代表参与形成的大
键原子数,n 代表参与形成的大![]() 键电子数(如苯分子中的大
键电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则
),则![]() 中的大
中的大![]() 键应表示为_______。
键应表示为_______。
(3)硼氢化锌[Zn ( BH4 )2 ]常用作有机合成中的还原剂,BH4-的VSEPR模型为______,与其互为等电子体的分子和阳离子有______(各写一种)。
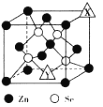
(4)硒化锌(ZnSe)是一种半导体材料,其晶胞结构如图所示,图中X和Y点所堆积的原子均为______(填元素符号);该晶胞中硒原子所处空隙类型为 _____(填“立方体”、 “正四面体”或“正八面体” ) ;若该晶胞的参数为a pm, NA代表阿伏加德罗常数的数值,则晶胞的密度为_____ gcm-3(用相关字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯),反应原理: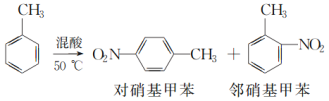
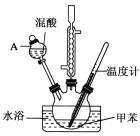
实验步骤:①浓硝酸与浓硫酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈烧瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈烧瓶中加入混酸;
④控制温度约为50~55℃,反应大约10min,三颈烧瓶底部有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g。
相关物质的性质如下:
有机物 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 |
甲苯 | 0.866 | 110.6 | 不溶于水 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(1)A的仪器名称是___。
(2)水浴加热的优点是__。
(3)配制混酸的方法是__。
(4)若实验后在三颈烧瓶中收集的产物较少,可能的原因是__。
(5)分离反应后产物的方案如下:
混合液![]()
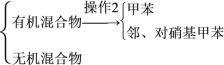
操作1的名称是__,操作2中不需要用到下列仪器中的__(填序号)。
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为__(结果保留至小数点后一位数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示错误的是
A.氮原子价层电子的轨道表示式:![]()
B.Cu2+基态核外电子排布式:1s22s22p63s23p63d9
C.HF分子间氢键示意图: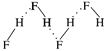
D.乙腈(CH3CN)的结构式:CH3-C≡N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,用强碱处理并没有NH3放出,则下列有关说法中正确的是
A.NH3与NO3-中氮原子的杂化方式相同B.配合物中心离子的电荷数和配位数均为4
C.PtCl4·2NH3的立体构型为正八面体形D.Cl-和NH3分子均与中心离子Pt4+配位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料尼龙 66 具有良好的抗冲击性、韧性、耐燃油性和阻燃、绝缘等特点,因此广泛应 用于汽车、电气等工业中。以下是生产尼龙 66 的一些途径。
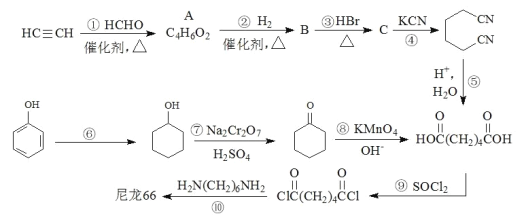
已知:连接在 C≡C 碳原子上的氢原子比较活泼,在催化剂作用下碳氢键易断裂。
(1)A 的结构简式为__________________________。
(2)B 中官能团的名称是__________________________。
(3)反应①~④中,属于加成反应的有__________________________,反应⑥~⑨中,属于氧化反应的有__________________________。
(4)请写出反应⑥的化学方程式__________________________。
(5)高分子材料尼龙 66 中含有![]() 结构片段,请写出反应⑩的化学方程式_____________________。
结构片段,请写出反应⑩的化学方程式_____________________。
(6)某聚合物 K 的单体与 A 互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为 1:2:3,且 能与 NaHCO3 溶液反应,则聚合物 K 的结构简式是__________________________。
(7)聚乳酸(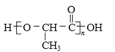 )是一种生物可降解材料,已知羰基化合物可发生下述反应:
)是一种生物可降解材料,已知羰基化合物可发生下述反应:![]() (R′可以是烃基或 H 原子)。用合成路线图表示用乙醇 制备聚乳酸的过程。__________________________
(R′可以是烃基或 H 原子)。用合成路线图表示用乙醇 制备聚乳酸的过程。__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向10 mL 0.1 mol·L-1一元弱碱XOH溶液中逐滴滴加0.1 mol·L-1的盐酸,溶液的AG[AG=lg![]() ]变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是( )
]变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是( )
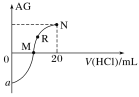
A.若a=-8,则Kb(XOH)≈10-6
B.M点表示盐酸和XOH恰好完全反应
C.R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D.M点到N点,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年为“国际化学元素周期表年”。如图所示是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是
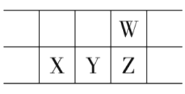
A.原子半径:W<X
B.气态氢化物热稳定性:Z<W
C.Y单质可用做半导体材料
D.X的最高价氧化物的水化物是强碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com