
| A. | 标准状况下,22.4L臭氧与22.4L氢气所含原子数均为2NA | |
| B. | 46gNO2和N2O4的混合气体中含有的原子数为3NA | |
| C. | 2.24LCH4所含电子数为NA | |
| D. | 1molO2参加反应转移的电子数一定为4NA |
分析 A.臭氧为3原子分子,氢气为双原子分子;
B.NO2和N2O4的最简式均为NO2;
C.气体状况未知,Vm不确定;
D.氧气与钠加热生成过氧化钠,过氧化钠中氧为+1价,据此解答;
解答 解:A.标准状况下,22.4L臭氧含原子数均为3NA,22.4L氢气所含原子数为2NA,故A错误;
B.NO2和N2O4的最简式均为NO2,46g NO2和N2O4混合气体中含有NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,故含有3mol原子,即3NA个,故B正确;
C.气体状况未知,Vm不确定,无法计算甲烷的物质的量,故C错误;
D.氧气与钠加热生成过氧化钠,过氧化钠中氧为+1价,1molO2参加反应转移2mol电子,故D错误;
故选:B.
点评 本题考查阿伏伽德罗常数的有关计算和判断,准确把握物质的量、粒子数、质量、体积等与阿伏伽德罗常数关系是解题关键,题目难度中等.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 该 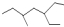 有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 棉花、羊毛、合成纤维、油脂的成分都是高分子化合物 | |
| C. | 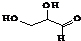 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧消耗氧气的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油液化气、汽油和石蜡的主要成分都是碳氢化合物 | |
| B. | CH3-CH=CH-CH3与C3H6一定互为同系物 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| D. | 等质量的乙烯和聚乙烯充分燃烧所需氧气的量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电离能序号 | I1 | I2 | I3 | I4 |
| 电离能(kJ/mol) | 740 | 1500 | 7700 | 10500 |
| A. | s区 | B. | p区 | C. | d区 | D. | ds区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:
碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 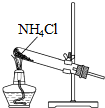 制取氨气 | B. | 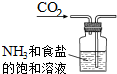 制取NaHCO3 | C. | 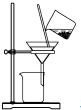 分离NaHCO3 | D. | 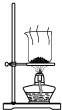 干燥NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
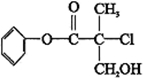
| A. | 有机物A 属于芳香烃 | |
| B. | 有机物A 可以与Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A 与浓硫酸混合加热,可以发生消去反应 | |
| D. | 1 mo1A 与足量的NaOH 溶液反应,最多可以消耗3mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com