
【题目】[化学-选修3:物质结构与性质]镁与铝、锰形成的合金广泛应用于航天、运输、化工等领域。回答下列问题:
(1)基态Mn2+核外电子排布式为_________________。
(2)下列各项比较中,Mg>Al的是____________(填选项序号)。
A.电负性 B.金属键的强弱 C.金属性 D.基态原子第一电离能
(3)叶绿素是以镁离子为中心的卟啉配合物,其结构如图。

①Mg2+与N原子形成的化学键为配位键的是__________(填“a”或“b”)。
②叶绿素分子中C原子的杂化轨道类型有______________。
(4)MgO具有NaCl型结构(如图),MgO晶体的熔点比NaCl高的原因是________________;其中阴离子采用面心立方最密堆积方式,阴离子的配位数为___________,r(O2-)=0.148mm,MgO的密度为___________g/cm3(NA表示阿伏加德罗常数的值,列出计算式)。

【答案】 1s22S22p63s23p63d5(或[Ar]3d5) CD b sp2、sp3 都是离子晶体,Mg半径小于Na+,O2-半径小于Cl-,MgO中离子电荷数大于NaCl中离子电荷数,所以MgO晶格能大,熔点高 6 ![]()
【解析】(1)Mn原子的核电荷数为25,1s22S22p63s23p63d54s2,基态Mn2+核外电子排布式为:1s22S22p63s23p63d5(或[Ar]3d5);正确答案:1s22S22p63s23p63d5(或[Ar]3d5)。
(2)同一周期,从左到右,电负性增大,所以电负性Mg<Al,A错误;核外电子排布相同的离子,核电荷数越大,离子半径越小,因此半径Mg2+>Al3+,离子半径越小,电子越多,金属键越大,所以Mg<Al,B错误;镁的金属性强于铝的,C正确;镁原子的3s轨道电子处于全充满状态,稳定性强,所以第一电离能大于铝的,D正确;正确选项CD。
(3) ①从结构图可知:在b中氮原子已经形成3条共价键,剩下的孤电子对与镁离子形成配位键,所以Mg2+与N原子形成的化学键为配位键的是b;正确答案:b。
②根据杂化轨道数=中心原子的孤电子对数+中心原子的σ键个数;叶绿素分子含有![]() 结构,杂化轨道数=0+3=3,C原子的杂化轨道为sp2;叶绿素分子含有
结构,杂化轨道数=0+3=3,C原子的杂化轨道为sp2;叶绿素分子含有![]() 结构,杂化轨道数=0+4=4,C原子的杂化轨道为sp3 ;正确答案:sp2;sp3。
结构,杂化轨道数=0+4=4,C原子的杂化轨道为sp3 ;正确答案:sp2;sp3。
(4) MgO和NaCl都是离子晶体,Mg半径小于Na+,O2-半径小于Cl-,MgO中离子电荷数大于NaCl中离子电荷数,所以MgO晶格能大,熔点高;根据MgO晶胞的结构可知,1个O2-周围有6个Mg2+,所以配位数为6;根据晶胞的结构可知,含有Mg2+个数为12×1/4+1=4, O2-个数为8×1/8+12×1/4=4,所以该晶胞含有4MgO,晶胞体积为4×40/ρNA cm3,由于 r (O2-)=0.148mm=0.148×10-7cm,根据晶胞的结构可知,该晶胞的棱长为a=2![]() =2
=2![]() ×0.148×10-7cm,所以a3=4×40/ρNA,ρ=
×0.148×10-7cm,所以a3=4×40/ρNA,ρ=![]() ;正确答案:都是离子晶体,Mg半径小于Na+,O2-半径小于Cl-,MgO中离子电荷数大于NaCl中离子电荷数,所以MgO晶格能大,熔点高 ;6 ;
;正确答案:都是离子晶体,Mg半径小于Na+,O2-半径小于Cl-,MgO中离子电荷数大于NaCl中离子电荷数,所以MgO晶格能大,熔点高 ;6 ; ![]() 。
。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图. 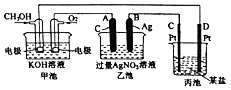
(1)通入O2的电极名称、C(Pt)电极的名称是 .
(2)写出通入O2的电极上的电极反应式是 .
(3)写出通入CH3OH的电极上的电极反应式是 .
(4)若丙池是电解饱和食盐水溶液,则阳极的电极反应为 , 阴极的电极反应为 . 在(阳极或阴极)附近滴入酚酞溶液变红.
(5)乙池中反应的化学方程式为 .
(6)当乙池中B(Ag)极的质里增加5.40g时,甲池中理论上消耗O2mL(标准状况下);若丙池中饱和食盐水溶液的体枳为500mL,电解后,溶液的pH= . (25℃,假设电解前后溶液的体积无变化).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离方法中不正确的是( )
A.利用萃取方法用四氯化碳提取溴水中的溴单质
B.利用蒸馏的方法可以分离沸点相差较大的液体混合物
C.利用分液的方法分离酒精和水
D.利用结晶的方法除去KNO3中的氯化钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将H2(g)和I2(g)各1mol的气态混合物充入2L的密闭容器中,充分反应,5min后达到平衡,测得c(HI)=0.2mol/L.
(1)计算从反应开始至达到平衡,用H2(g)表示的反应速率.
(2)求该反应的平衡常数.
(3)保持温度不变,若向上述容器中充入H2(g)和I2(g)各2mol,求达到平衡时I2(g)的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层电子数的3倍;元素W基态原子的核外电子共有16种运动状态.
(1)①在元素周期表中,元素X位于区,元素Y在周期表中的位置是 . ②Z所在周期中,第一电离能最大的元素是(填元素名称).
③X+的核外电子排布式为 .
④Y和W两元素最高价氧化物对应的水化物酸性较强的是(填化学式).
(2)X与Y所形成化合物晶体的晶胞如下图所示.在1个晶胞中,X离子的数目为;该化合物的化学式为 . 
(3)①在乙醇中的溶解度:Z的氢化物(H2Z)大于H2W,其主要原因是 . ②稳定性:H2ZH2W(填“>”、“<”或“=”),其主要原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.水导电性很差,所以水是非电解质
B.电解质与非电解质的本质区别,是在一定条件下自身能否电离
C.酸、碱和盐类都属于电解质,其他化合物一定都是非电解质
D.NaCl和HCl都是电解质,所以它们熔融状态下都能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.950mL,111gB.1000mL,117g
C.1000mL,117.0gD.950mL,111.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向盛有50mLpH=2的HA溶液的绝热容器中加入pH =13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是
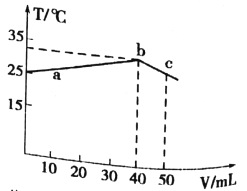
A. a→b 的过程中,混合溶液中可能存在:c(A-)=c(Na+)=c(H+) =c(OH-)
B. HA的物质的量浓度为0.01mol/L
C. b点时,溶液中存在:c(Na+)>c(A-)>c(OH-)>c(H+)
D. b→c的过程中,温度降低的原因是溶液中发生了吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com