
 已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:
已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
| △c |
| △t |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| 0.20mol/L-0.08mol/L |
| 4min |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c×c |
| (0.02-c)(0.02-c) |
| 0.015 |
| 0.2 |
| (1-x)y×(1-x)y |
| (1-x)(1-y)×(x-y+xy) |


科目:高中化学 来源: 题型:
| A、溶液中c(H+)和c(OH-)都减小 |
| B、溶液中c(H+)增大 |
| C、醋酸电离平衡向右移动 |
| D、溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
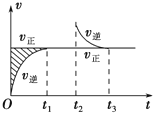 恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件.下列有关说法中正确的是( )
恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件.下列有关说法中正确的是( )| A、Z和W在该条件下都不可能为气态 |
| B、t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
| C、若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
| D、若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等. |
查看答案和解析>>
科目:高中化学 来源: 题型:
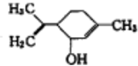
| A、能与氢氧化钠溶液发生中和反应 |
| B、能发生加成反应和取代反应 |
| C、不能使酸性高锰酸钾溶液褪色 |
D、与对丙基苯甲醇( )互为同分异构体 )互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应式为Pb-2e-+SO42-=PbSO4 |
| B、充放电时,溶液的导电能力变化不大 |
| C、以该电池电解NaCl溶液时,当消耗207gPb时,在阳极生成Cl222.4L |
| D、充电时的阳极反应式为Pb 2++2e-+4OH-=PbO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B、熔点由高到低:Na>Mg>Al |
| C、硬度由大到小:金刚石>碳化硅>晶体硅 |
| D、电负性由大到小:F>O>S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol?L-1 |
| B、2.5 mol?L-1 |
| C、5 mol?L-1 |
| D、7.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10mx | ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com