
| A. | 乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应 | |
| B. | CH3CH2CH3分子中的3个碳原子不可能在同一直线上 | |
| C. | 聚氯乙烯、麦芽糖和蛋白质均属于有机高分子化合物 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同 |
分析 A.乙烯与溴水发生加成反应,与高锰酸钾发生氧化还原反应;
B.CH3CH2CH3为烷烃,具有甲烷的结构特点;
C.高分子化合物的相对分子质量在10000以上;
D.可将乙醇拆写成C2H4•H2O的形式来分析.
解答 解:A.乙烯含有碳碳双键,可与溴水发生加成反应,与高锰酸钾发生氧化还原反应,反应类型不同,故A错误;
B.CH3CH2CH3为烷烃,具有甲烷的结构特点,则3个碳原子不可能在同一直线上,故B正确;
C.麦芽糖相对分子质量较小,不是高分子化合物,故C错误;
D.乙醇可拆写成C2H4•H2O的形式,等质量的C2H4和C2H4•H2O含C2H4,乙烯高于乙醇,故消耗氧气的量乙烯大于乙醇,故D错误.
故选B.
点评 本题综合考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握有机物的组成、结构和性质的关系,难度不大,易错点为D,注意分子组成的特点.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 强酸pH=a,加水稀释到10n倍,则pH=a+n | |
| B. | 弱酸pH=a,加水稀释到10n倍,则pH<a+n(a+n<7) | |
| C. | 强碱pH=b,加水稀释到10n倍,则pH=b-n | |
| D. | 弱碱pH=b,加水稀释到10n倍,则pH=b-n(b-n>7) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:rW>rZ>rY | |
| B. | 化合物ZX中各原子均满足8电子稳定结构 | |
| C. | 由X、Y、Z、W组成的化合物的水溶液可能显酸性 | |
| D. | 简单气态氢化物稳定性:W>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| B. | 1.0L 1.0mol•L-1Na2SO4水溶液中含有的氧原子数为4NA | |
| C. | 电解饱和食盐水,当阴极产生1.12LH2时,转移的电子数为0.1NA | |
| D. | 常温下,2L0.1mol•L-1FeCl3溶液与1L0.2mol•L-1FeCl3溶液所含Fe3+数目不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向Al2(SO4)3溶液中滴加过量氨水 | 溶液先浑浊后澄清 | Al(OH )3能溶于氨水 |
| B | 将浓硫酸滴在胆矾晶体上 | 蓝色晶体变白 | 浓硫酸具有脱水性 |
| C | 将新制的氯水滴在蓝色石蕊试纸上 | 试纸先变红后褪色 | Cl2有漂白性 |
| D | 向某晶体的水溶液中加入2滴FeSO4溶液 | 产生特征蓝色沉淀 | 该晶体中一定含有[F e(CN)6]3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石蜡油经分馏可以获得乙烯 | |
| B. | 乙二酸、苯酚、苯乙烯均可发生聚合反应 | |
| C. | 室温下,在水中的溶解度:丙烷>乙醇>乙二醇 | |
| D. | 可用碘水和银氨溶液鉴别葡萄糖、麦芽糖和淀粉三种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
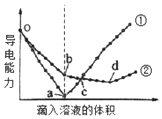 在两份15mL、1mol/L的Ba(OH)2溶液中,分别滴入H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
在两份15mL、1mol/L的Ba(OH)2溶液中,分别滴入H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | o-b段,发生的离子方程式:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | bd段,发生的离子方程式:OH-+H+═H2O | |
| C. | c点,两溶液中阴、阳离子的浓度之和相等 | |
| D. | o-a段加入溶液的体积为20mL,则NaHSO4溶液的浓度为0.75mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com