
下列有关热化学方程式的叙述正确的是( )
|
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ•mol﹣1,则氢气的标准燃烧热为﹣241.8 kJ•mol﹣1 |
|
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
|
| C. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.65 kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJ•mol﹣1 |
|
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
| 热化学方程式;反应热的大小比较.. | |
| 分析: | A、从燃烧热的定义来判断,燃烧热必须是生成稳定的氧化物. B、从反应的吸放热角度能判断出石墨和金刚石的能量的高低,从而比较出稳定性. C、从中和热的定义来判断,中和热的热化学方程式必须让生成的水为1mol. D、比较反应热的大小时要带着正负号比较. |
| 解答: | A、燃烧热指的是在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量.定义要点:物质必须是完全燃烧生成稳定的氧化物,即反应物中C→CO2,H2→H2O(l),S→SO2(g).故241.8kJ/mol不是氢气的燃烧热.故A错误; B、由C(石墨,s)═C(金刚石,s)△H>0,可知反应吸热,即石墨的能量低于金刚石,而能量越低物质越稳定,故石墨比金刚石稳定,故B错误; C、在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热中和热.20.0gNaOH的物质的量n== D、反应 C(s)+O2(g)═CO2(g)△H1 ①和反应 C(s)+1/2 O2(g)═CO(g)△H2 ②均为放热反应,△H均小于0. 由于反应①是碳的完全燃烧,②是碳的不完全燃烧,故①放出的热量多于②,则△H1<△H2.故D错误. 故选C. |
| 点评: | 本题考查了燃烧热的概念、中和热的计算以及反应热的大小比较,较简单. |


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
下列离子方程式书写正确的是 ( )
A.钠与硫 酸铜溶液反应:Cu2++2Na=2Na++Cu
酸铜溶液反应:Cu2++2Na=2Na++Cu
B.铁屑溶于过量稀硝酸:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
C.石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
D.FeI2溶液中通人少量氯气:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学
B.蔗糖、淀粉、油脂及其水解产物均为非电解质
C.通过红外光谱分析可以区分乙醇和乙酸乙酯
D.石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃.
查看答案和解析>>
科目:高中化学 来源: 题型:
德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面.下列说法正确的是( )
|
| A. | 水、双氧水、水玻璃都是纯净物 |
|
| B. | 石墨和C60互称为同位素 |
|
| C. | 磷酸是强电解质 |
|
| D. | 一定条件下石墨转化为C60是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
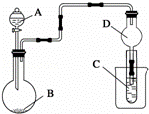
|
| A. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
|
| B. | 实验仪器D可以起到防止溶液倒吸的作用 |
|
| C. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
|
| D. | 若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液不变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
固体粉末X中可能含有FeO、Fe2O3、MnO2、K2S、K2SO3、KAlO2、MgCl2、K2SO4、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:
根据上述实验,以下说法正确的是( )
|
| A. | 原混合物中一定含有Fe2O3 |
|
| B. | 气体A一定均为纯净物 |
|
| C. | 气体C是纯净的氯气 |
|
| D. | 溶液甲中一定含有K2S、K2SO3、NaNO2、K2SO4可能含有KAlO2、K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
双隔膜电解池的结构示意简图如图所示,对该装置及其原理判断错误的是
( )
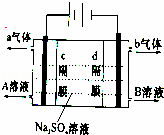
|
| A. | c隔膜为阴离子交换膜、d隔膜为阳离子交换膜 |
|
| B. | A溶液为硫酸,B溶液为氢氧化钠 |
|
| C. | a气体为氢气,b气体为氧气 |
|
| D. | 该电解反应的总方程式为:2Na2SO4+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
某废水中可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2一、CO32-、S2一、SO32-、SO42-
现取该溶液进行有关实验,实验过程及现象如下:
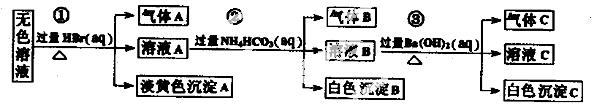
下列说法正确的是
A.根据实验①中的现象可推出,气体A一定是纯净物,淡黄色沉淀一定是AgBr
B.根据实验②中的现象可推出,气体B是CO2,沉淀B是Al(OH)3,原溶液中一定含有Al3+
C.根据实验③中的现象可推出,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4
D.原溶液中肯定含有Na+、AlO2-、S2-,不能确定是否含有SO32-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com