
【题目】在酸性条件下,黄铁矿( FeS2)催化氧化的反应方程式为2FeS2+7O2+2H2O=2Fe2++4SO42-+4H+,实现该反应的物质间转化如图所示。下列分析错误的是
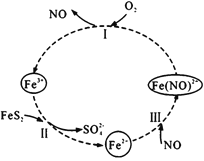
A.反应I的离子方程式为4Fe(NO)2++O2+4H+= 4Fe3++4NO+2H2O
B.反应Ⅱ的氧化剂是Fe3+
C.反应Ш是氧化还原反应
D.黄铁矿催化氧化中NO作催化剂
【答案】C
【解析】
A.根据图示,反应I的反应物为Fe(NO)2+和O2,生成物是Fe3+和NO,结合总反应方程式,反应的离子方程式为4Fe(NO)2++O2+4H+= 4Fe3++4NO+2H2O,故A正确;
B.根据图示,反应Ⅱ的反应物是Fe3+和FeS2,生成物是Fe2+和SO42-,反应中铁元素的化合价降低,氧化剂是Fe3+,故B正确;
C.根据图示,反应Ш的反应物是Fe2+和NO,生成物是Fe(NO)2+,没有元素的化合价发生变化,不是氧化还原反应,故C错误;
D.根据2FeS2+7O2+2H2O=2Fe2++4SO42-+4H+,反应过程中NO参与反应,最后还变成NO,NO作催化剂,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】2020年5月1日北京市在全市范围内开展施行垃圾分类,下列垃圾分类不正确是( )
A.鱼骨、菜叶 | B.消毒剂及其包装物 | C.破损的易拉罐 | D.破碎玻璃 |
|
|
|
|
厨余垃圾 | 有害垃圾 | 可回收垃圾 | 其他垃圾 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)天然气属于混合物,其组成以甲烷为主。该分子的电子式是________,其空间结构是______。
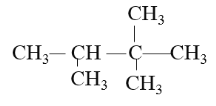
(2)2-甲基丁烷的结构简式是___,其一氯代物有___种。
(3)用系统命名法命名烃:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50ml浓H2SO4溶液(足量)中加入3.2gCu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________生成SO2的体积为(标准状况下)____________mL.
(2)若题干中浓硫酸的物质的量浓度为amol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)____0.025amol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,则原浓硫酸的物质的量浓度为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中,1molN2和3molH2催化反应后分子总数为2NA
B.100g98%的浓H2 SO4与过量的Cu反应后,电子转移数为NA
C.标准状况下,11.2L氧气和二氧化碳混合物中含氧原子数目为NA
D.1L1mol/LNa2CO3溶液中所含阴离子数目小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol/L二元弱酸H2A溶液中滴加0.1mol/LNaOH溶液,溶液中的H2A、HA-、A2 -的物质的量分数δ(x)随pH的变化如图所示。下列说法错误的是

A.pH =1.9时,c(Na+)<c(HA-)+2c(A2-)
B.当c(Na+)=c(H2A)+c(HA-)+c(A2-)时,溶液pH>7
C.pH=6时,c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.lg[Ka2(H2A)]=-7.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸亚铁可用作媒染剂、分析试剂、催化剂等。
(1)硝酸亚铁可用铁屑在低温下溶于稀硝酸制得,还原产物为NO。反应的化学方程式为________。
(2)某小组为探究硝酸亚铁晶体的热分解产物,按下图所示装置进行实验。
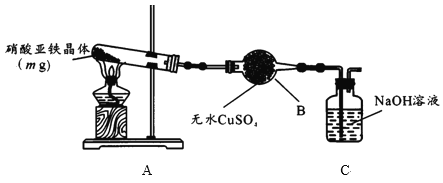
①仪器B的名称是____,实验中无水CuSO4变蓝,由此可知硝酸亚铁晶体含有___。
②实验中观察到A装置的试管中有红棕色气体生成,检验热分解后固体为氧化铁的实验方案为:
实验步骤 | 现象 |
取少量固体加适量稀硫酸,振荡,将溶液分成两份 | 固体溶解得黄色溶液 |
一份滴入____ | 溶液变成红色 |
另一份滴入1~2滴K3 [Fe(CN)6]溶液 | ___________ |
A中硝酸亚铁晶体[Fe(NO3)2·xH2O]分解的化学方程式为______ 。
(3)继续探究mg硝酸亚铁晶体中铁元素的质量分数
①取A中热分解后的固体放入锥形瓶,用稀硫酸溶解,加入过量的KI溶液,滴入2滴___作指示剂。
②用a mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液(已知:I2+2S2O32-=2I-+S4O62-),滴定至终点时用去bmLNa2S2O3溶液,则硝酸亚铁晶体中铁的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究废旧电池的再利用,实验室利用旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示。下列叙述错误的是

A. “溶解”操作中溶液温度不宜过高
B. 铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的氧气或H2O2
C. 与锌粉反应的离子可能为Cu2+、H+
D. “过滤”操作后,将滤液蒸发结晶、过滤、洗涤、干燥后,高温灼烧即可得纯净的ZnO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com