
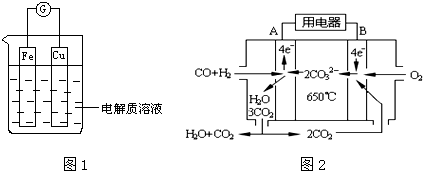
分析 (1)在原电池中,易失电子的电极为负极,另一个电极为正极
①当电解质溶液为稀硫酸时,铁易失电子作负极、Cu作正极,正极上氢离子放电;
②当电解质溶液为浓硝酸时,铜易失电子作负极,负极上铜失电子生成铜离子;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电;
(3)4g H2的物质的量是2mol,4g H2燃烧生成液态水时放热为571.6kJ,则1mol燃烧生成液态水时放热为285.8kJ;
(4)由图可知,B为正极,氧气得到电子;
(5)根据盖斯定律②-①+③+⑤得到NH4Cl(s)+H2O(l)═NH4Cl(aq)△H4.
解答 解:(1)①当电解质溶液为稀硫酸时,铁易失电子作负极、Cu作正极,正极上氢离子放电,Cu电极上电极反应式为2H++2e-=H2↑,故答案为:正;2H++2e-=H2↑;
②当电解质溶液为浓硝酸时,铁和浓硝酸发生钝化现象,所以铜易失电子作负极,负极上铜失电子生成铜离子,电极反应式为Cu-2e-=Cu2+,故答案为:负;Cu-2e-=Cu2+;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电,电池反应式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,
故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
(3)4g H2的物质的量是2mol,4g H2燃烧生成液态水时放热为571.6kJ,则1mol燃烧生成液态水时放热为285.8kJ,则氢气的燃烧热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.6 kJ•mol-1,故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.6 kJ•mol-1;
(4)由图可知,B为正极,氧气得到电子,正极反应为O2+2CO2+4e-=2CO32-,故答案为:O2+2CO2+4e-=2CO32-;
(5)①NH3(g)+HCl(g)═NH4Cl(s)△H1=-176kJ•mol-1
②NH3(g)+H2O(l)═NH3•H2O(aq)△H2=-35.1kJ•mol-1
③HCl(g)+H2O(l)═HCl(aq)△H3=-72.3kJ•mol-1
④NH4Cl(s)+H2O(l)═NH4Cl(aq)△H4=?
⑤NH3•H2O(aq)+HCl(aq)═NH4Cl(aq)+H2O(l)△H5=-52.3kJ•mol-1.
由盖斯定律 ②-①+③+⑤得到NH4Cl(s)+H2O(l)═NH4Cl(aq)△H4=△H2-△H1+△H3+△H5=+16.3kJ•mol-1,故答案为:+16.3kJ•mol-1.
点评 本题考查电解原理及应用,为高频考点,把握原电池、电解池的工作原理为解答的关键,侧重分析与应用能力的考查,注意(5)中利用盖斯定律计算,题目难度不大.


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | 食盐 | B. | 火碱 | C. | 草木灰 | D. | 胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “山东疫苗案”涉疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| B. | 硫、氮、碳的氧化物是形成酸雨的主要物质 | |
| C. | 半导体行业中有一句“行话”:“从沙滩到用户”,说明计算机芯片的主要成分是二氧化硅 | |
| D. | 自来水厂常用明矾作消毒杀菌剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
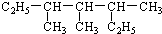 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法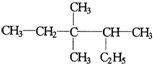 的名称为3,3-二甲基-2-乙基戊烷 的名称为3,3-二甲基-2-乙基戊烷 | |
| B. | 乙烯、乙炔是较活泼的有机物,能发生氧化反应,甲烷和苯性质较稳定,不能发生氧化反应 | |
| C. | 分子式为C5H12O的醇共有8种,其中能催化氧化成醛的同分异构体有4种 | |
| D. | A、B两种有机化合物,无论以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生水的质量也不变,则A、B满足的条件必须是最简式相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
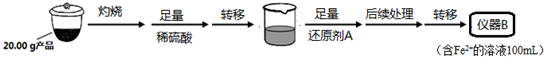
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积 | 20.00mL | 19.98mL | 21.38mL | 20.02mL |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 250mL | B. | 375mL | C. | 475mL | D. | 500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
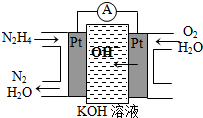 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com