
| 实验 | 试剂 | 现象 | |
| 滴管 | 试管 | ||
 | 0.2mol/L Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ产生白色沉淀 |
| 0.2mol/LCuSO4溶液 | Ⅱ溶液变绿,继续滴加产生棕黄色沉淀 | ||
| 0.1mol/LAl2(SO4)3溶液 | Ⅲ开始无明显变化,继续滴加产生白色沉淀 | ||

分析 (1)0.2mol/LNa2SO3溶液滴入饱和Ag2SO4溶液发生反应生成白色沉淀Ag2SO3;
(2)①根据第二题中现象2及已知信息,可以得知,取少量洗净(排除Cu2+干扰)的棕黄色沉淀,滴加稀硫酸,沉淀变红(铜单质),则证明有 Cu+;
②a.根据BaSO4沉淀可知,加入的试剂为含Ba2+的化合物,可以选用BaCl2;
b.由白色沉淀A可知之前所取上层清液中有SO42-,由加入KI生成白色沉淀可知棕黄色沉淀中含有Cu2+,Cu2+和I-作用生成CuI白色沉淀,由加淀粉无现象说明上层清液中无I2,而Cu2+和I-反应生成I2,因而推断生成的I2参与了其他反应,因而有还原剂SO32-;
解答 解:(1)实验Ⅰ中0.2mol/LNa2SO3溶液滴入饱和Ag2SO4溶液,由于Ag2SO4饱和溶液且溶液混合后稀释,因此不可能是Ag2SO4沉淀,考虑SO32-浓度较大,因此推断白色沉淀为Ag2SO3,反应的离子方程式为:2Ag++SO32-=Ag2SO3↓,故答案为:2Ag++SO32-=Ag2SO3↓;
(2)①依据反应Cu+和稀硫酸反应铜和铜离子,若沉淀中含有Cu+,加入稀硫酸会发生歧化反应生成铜单质,实验现象是有红色固体生成,
故答案为:析出红色固体;
②a.分析实验流程可知实验原理为2Cu2++4I-=2CuI+I2、I2+SO32-+H2O=SO42-+2I-+2H+、SO42-+Ba2+=BaSO4↓,根据BaSO4沉淀可知,加入的试剂为含Ba2+的化合物,可以选用BaCl2溶液,考虑沉淀A没有BaSO3,因此应在酸性环境中.
故答案为:HCl和BaCl2溶液;
b.由白色沉淀A可知之前所取上层清液中有SO42-,由加入KI生成白色沉淀可知棕黄色沉淀中含有Cu2+,Cu2+和I-作用生成CuI白色沉淀,由加淀粉无现象说明上层清液中无I2,而Cu2+和I-反应生成I2,因而推断生成的I2参与了其他反应,因而有还原剂SO32-;
故答案为:棕黄色沉淀与KI溶液反应生成白色沉淀(CuI),证明含有Cu2+,白色沉淀A为硫酸钡,证明含有SO32-;
点评 本题考查化学实验方案的分析、评价和设计.主要是离子检验和实验过程的理解应用,题目难度较大.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的H2O与D2O含有的中子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 同温、同压、同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的镁和铝分别与足量氯气完全反应时转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | SO2起始浓度(mol•L-1) | O2起始浓度(mol•L-1) | 平衡时SO3 体积分数(%) |
| T1 | 2 | 1 | ω1 |
| T1 | 4 | 2 | ω2 |
| T2 | 4 | 2 | ω1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比例模型 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |
| B. | 2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO | |
| C. | 石油的分馏和煤的干馏都是发生了物理变化 | |
| D. | 用 CH3CH218OH 与乙酸反应制取乙酸乙酯,18O 存在于水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
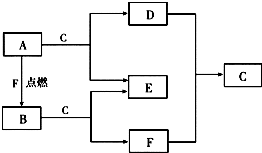 A、D、F均是由短周期元素组成的单质,常温下C是液体.
A、D、F均是由短周期元素组成的单质,常温下C是液体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有CC双键的数目为3NA | |
| C. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(l)△H1 2H2(g)+O2(g)=2H2O(g)△H2 | |
| B. | S(g)+O2(g)=SO2(g)△H1 S(s)+O2(g)=SO2(g)△H2 | |
| C. | C(s)+O2(g)=CO(g)△H1 C(s)+O2(g)=CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g)△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23gNa一定条件下与足量的O2反应转移的电子数一定为NA | |
| B. | 标准状态下,2.24LCCl4中的分子数目为0.1NA | |
| C. | 1L1 mol/L饱和FeCl3溶液滴入沸水中完全水解生成NA个氢氧化铁胶体粒子 | |
| D. | 0.1 mol•L-1 氢氧化钠溶液中所含钠离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com