
分析 (1)依据氧化反应和还原反应电子守恒,合并书写离子方程式;
(2)根据元素化合价变化判断氧化剂,元素化合价降低的物质做氧化剂,元素化合价升高做还原剂被氧化,依据离子方程式计算电子转移数;
(3)锰离子催化过氧化氢分解生成水和氧气,依据分解反应计算电子转移数.
解答 解:(1)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
①氧化反应:H2O2-2e-═2H++O2↑
②还原反应:MnO4-+5e-+8H+═Mn2++4H2O
①×5+②×2得到:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;
故答案为:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;
(2)依据反应中化合价降低的元素是锰元素,从+7价降到+2价,所以氧化剂是KMnO4,过氧化氢中氧元素化合价从-1价升高到0价,做还原剂被氧化,若有0.5mol H2O2参加此反应,根据离子方程式5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;可知转移电子数1mol,转移电子个数为6.02×1023;故答案为:KMnO4,氧,6.02×1023;
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑; H2O2发生分解,氧元素化合价从-1价变化为0价和-2价,每2mol过氧化氢反应转移电子为2mol,若有0.5mol H2O2发生分解,则转移电子个数为0.5mol,即转移电子个数为3.01×1023;
故答案为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑; 3.01×1023.
点评 本题考查了氧化还原反应的离子方程式书写,氧化还原反应的概念分析判断,反应电子转移的计算,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Fe2+和 Fe3+ | B. | Fe2+ | C. | Cu2+ 和Fe2+ | D. | Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅单质溶于入氢氧化钠溶液中:Si+2OH-+H2O═SiO3-+2H2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 在碳酸氢镁溶液中加入过量氢氧化钠溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| D. | 向NaAlO2溶液中加入过量稀盐酸:AlO2-+4H+═Al3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
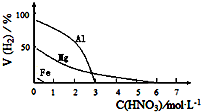 HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:| 影响因素 | 实验步骤 | 实验结论 |
| 金属的种类 | 两只烧瓶中各放入5g颗粒大小大致相同的Fe粉、Mg粉,分别加入2mol•L-1 HNO3溶液50mL,反应结束后,用气体分析仪测定气体中H2的体积分数 | 在该浓度的稀HNO3中,Mg能反应, Fe粉不反应, |
| 硝酸的浓度 | 两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,分别加入0.1mol•L-1HNO3、2.0mol•L-1HNO3,反应结束后,用气体分析仪测定气体中H2的体积分数 | 硝酸浓度越稀,产生氢气越多. |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
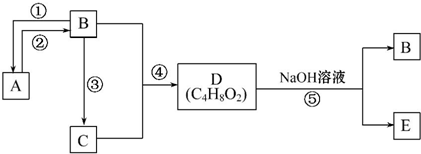
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①③④ | C. | ①② | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 卤族元素中Cl、Br、I在海洋中含量丰富,F在自然界中常以CaF2的形式存在.
卤族元素中Cl、Br、I在海洋中含量丰富,F在自然界中常以CaF2的形式存在. ,1molNH4NO3中含有σ键数目为7mol(或7×6.02×1023).其中阴、阳离子中心原子杂化类型分别为:sp2、sp3.
,1molNH4NO3中含有σ键数目为7mol(或7×6.02×1023).其中阴、阳离子中心原子杂化类型分别为:sp2、sp3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有过渡元素都是金属元素 | |
| B. | CaO2和CaCl2含有的化学键类型完全相同 | |
| C. | 非金属原子之间不可能形成离子键 | |
| D. | 有化学键断裂的过程一定属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
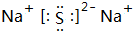 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com