
| A、0.1mol/LAlCl3溶液中含有的Cl-数目为0.3NA |
| B、室温下,42.0g己烯和丙烯的混合气体中含有的碳原子数为3NA |
| C、标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |
| D、100mL18.4mol/L硫酸与足量铜反应,生成SO2的分子数为0.92NA |
| 42g |
| 14g/mol |


科目:高中化学 来源: 题型:
| A、“钴酞菁”分子所形成的分散系具有丁达尔效应 |
| B、该物质属于有机高分子化合物 |
| C、此项工作的研究表明,人们可以改变分子的某些物理性质 |
| D、此项研究结果可广泛应用于光电器件、生物技术等方面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高压、低温有助于可燃冰的形成 |
| B、构成可燃冰的原子间存在极性共价键 |
| C、可燃冰的微粒间可能存在一种比范德华力更强的相互作用力 |
| D、常温、常压下可燃冰是一种稳定的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
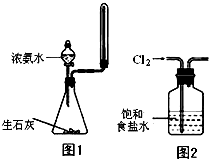 下列有关实验没有明显错误的是( )
下列有关实验没有明显错误的是( )| A、使用湿润过的pH试纸测量某溶液的pH |
| B、实验室可以用图1所示装置来制取少量氨气 |
| C、用量筒量取20 mL 0.50mol?L-1H2SO4溶液于烧杯中,加水80 mL,配制成0.10mol?L-1H2SO4溶液 |
| D、实验室用图2所示装置除去Cl2中的少量HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
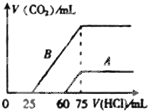 向10mL某浓度的NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有图示两种情况,则下列分析判断不正确的是(不考虑CO2的溶解)( )
向10mL某浓度的NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有图示两种情况,则下列分析判断不正确的是(不考虑CO2的溶解)( )| A、曲线A表明M中的溶质为NaOH、Na2CO3 |
| B、曲线B表明M中NaHCO3与Na2CO3的物质的量之比为1:2 |
| C、原NaOH溶液的物质的量浓度为0.75mol/L |
| D、由A.B可知,两次实验通入的CO2的体积比3:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、绿色化学就是研究绿色物质的化学 |
| B、烷烃是一类饱和链烃,其分子都是直线型的 |
| C、甲烷是烷烃中碳元素的质量分数最低的,也是最简单的烃 |
| D、“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是指纤维素和油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HF水溶液可存放在玻璃试剂瓶中 |
| B、Br2可从KCl溶液中置换出氯 |
| C、F、Cl、Br、I的非金属性依次减弱 |
| D、HF、HCl、HBr、HI的稳定性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=6.8的溶液一定显酸性 |
| B、电离平衡常数(K)只与弱电解质本身有关,与其它外部因素无关 |
| C、0.1 mol?L-1的硫化钠溶液中:c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-) |
| D、相同物质的量浓度的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,则c(NH4+)由大到小的顺序是:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | XOH物质的量浓度(mol?L-1) | HCl物质的量浓度(mol?L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com