
| A. | KI溶液在空气久置变黄:4I-+O2+4H+=2I2+2H2O | |
| B. | 用稀盐酸除去久存石灰水的烧杯内壁上的固体:2H++Ca(OH)2=Ca2++2H2O | |
| C. | 用酸性KMnO4溶液除去CO2中SO2:3SO2+2MnO4-+4H+=3SO42-+2MnO2↓+H2O | |
| D. | 用足量饱和Na2CO3溶液吸收制备的乙酸乙酯:CO32-+CH3COOH=HCO3-+CH3COO- |
分析 A.碘化钾溶液呈中性,反应物中不存在氢离子;
B.久存石灰水的烧杯内壁上的固体为碳酸钙,不是氢氧化钙;
C.高锰酸根离子被还原成锰离子,且该反应违反了电荷守恒;
D.乙酸乙酯中混有乙酸,乙酸与足量的碳酸钠溶液反应生成乙酸钠和碳酸氢钠.
解答 解:A.KI溶液在空气久置变黄,碘离子被空气中氧气氧化,正确的离子方程式为:4I-+O2+2H2O=4OH-+2I2,故A错误;
B.用稀盐酸除去久存石灰水的烧杯内壁上的固体,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳气体和水,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故B错误;
C.用酸性KMnO4溶液除去CO2中SO2,二氧化硫被氧化成硫酸根离子,高锰酸根离子被二氧化硫还原成锰离子,正确的离子方程式为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,故C错误;
D.用足量饱和Na2CO3溶液吸收制备的乙酸乙酯,由于碳酸钠过量,则反应生成碳酸氢钠,反应的离子方程式为:CO32-+CH3COOH=HCO3-+CH3COO-,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等;试题有利于提高学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
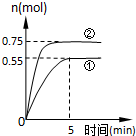 碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:
碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发、萃取、分液 | B. | 分液、结晶、蒸发 | C. | 过滤、蒸发、萃取 | D. | 萃取、过滤、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素形成的化合物不可能是离子化合物 | |
| B. | 金属原子和非金属原子间也可形成共价键 | |
| C. | 离子化合物中可能含有共价键 | |
| D. | 共价化合物中不能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 负极发生的反应为:Fe-2e-=Fe 2+ | |
| C. | 正极发生的反应为:2H2O+O2+2e-=4OH- | |
| D. | 钢柱在水下的部分比在空气和水交界出更容易腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
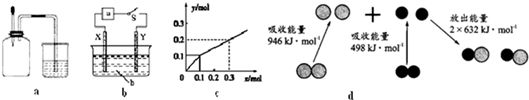
| A. | 如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 | |
| B. | 如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a | |
| C. | Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+ | |
| D. | 图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g)△H=-180 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2既是氧化产物又是还原产物 | |
| B. | 反应通式配平为6NOx+4xNH3=(3+2x)N2+6xH2O | |
| C. | 当x=1时,每生成2.5mol N2,被氧化的气体有3mol | |
| D. | 当x=2时,有1mol气体被还原时,转移的电子为4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com