
【题目】下列有关电池的叙述正确的是( )
A. 手机上用的锂电池属于一次电池
B. 锌锰干电池中,为了延长电池寿命,可将NH4Cl换成KOH
C. 甲烷燃料电池工作时甲烷在负极被还原
D. 太阳能电池的主要材料为二氧化硅
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,还含有少量重金属化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上采用同槽酸浸工艺制备碳酸锰并回收硫酸铵,其主要流程如下:

(1)为了提高浸出率,在浸取时可采取的措施有________。
A.适当升高温度 B.搅拌 C.矿石研成粉末 D.延长浸泡时间
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,浸取时发生反应的离子方程式是___________________________。
(3)加入MnO2氧化发生反应的离子方程式是___________________,还可使用______代替MnO2。
(4)滤渣2主要成分的化学式是________________。
(5)50℃碳化发生的化学反应方程式是______________________。
(6)加水洗涤,检验碳酸锰产品完全洗净的方法是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1mol/L Na2CO3溶液的叙述错误的是( )
A.0.5 L该溶液中钠离子的物质的量浓度为0.1 mol/L
B.1 L该溶液中含有Na2CO3的质量为10.6 g
C.从1 L该溶液中取出100 mL,则取出溶液中Na2CO3的物质的量浓度为0.01 mol/L
D.取该溶液10 mL,加水稀释至100 mL后,Na2CO3的物质的量浓度为0.01 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中氢离子浓度最小的是( )
A.pH=0的NaHSO4溶液B.0.04mol·L-1硫酸
C.pH=3醋酸溶液D.0.5mol·L-1盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知新型中温全瓷铁—空气电池,其结构简式如图所示。下列说法正确的是
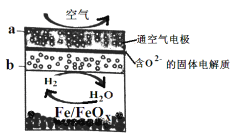
A. 铁表面发生的反应为 xH2O(g)+Fe=FeOx+xH2
B. a 极发生氧化反应
C. 正极的电极反应为 FeOx+2xe- =Fe+xO2-
D. 若有 22.4L(标准状况 )空气参与反应,则电路中有 4mol 电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3可用于半导体生产的外延、扩散工序,有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 |
PCl3 | —112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
(一)制备:RU 图是实验室制备PCl3的装置(部分仪器已省略)

(1)仪器乙的名称___________。
(2)实验室用漂白粉加浓盐酸制备Cl2的化学方程式:__________ 。
(3)碱石灰的作用是__________、___________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一 段时间的CO2,其目的是________。
(二)提纯:
(5)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过________(填实验操作名称),即可得到PCl3的纯品。
(三)分析:
测定产品中PCl3纯度的方法如下:迅速称取4.200 g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的0.1000 mol/L 20.00 mL 碘溶液,充分反应后再用0.1000 mol/L Na2S2O3溶液滴定过量的碘,终点时消耗10.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
(6)根据上述数据,该产品中PCl3的质量分数为______________。若滴定终点时俯视读数,则PCl3的质量分数_________(偏大、偏小、或无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氯酸钾和二氧化锰制取氧气的反应方程式为:2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
回答下列问题:
(1)该反应中被氧化的元素名称为 , 生成1mol O2时转移电子的数目是 .
(2)从反应后的固体混合物中分离出难溶于水的MnO2的具体实验操作名称: .
(3)分离出的MnO2可用于实验室制取Cl2 , 化学方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,其离子方程式为 .
MnCl2+Cl2↑+2H2O,其离子方程式为 .
(4)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为
(5)以上两个反应都用到MnO2 , 其作用分别是、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂和还原剂的物质的量之比最大的是( )
A. 氯气和氨气 3Cl2 + 8NH3 = N2 + 6NH4Cl
B. 铜和稀硝酸3Cu + 8HNO3(稀) = 2NO↑+ 3Cu(NO3)2 + 4H2O
C. 氢气和氧化铁 3H2 + Fe2O3![]() 2Fe + 3H2O
2Fe + 3H2O
D. 二氧化锰和盐酸 MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mL氯化镁和氯化铝的混合液中,Mg2+的物质的量浓度为0.2mol/L,Cl﹣的物质的量浓度为1.3mol/L.要使Mg2+全部转化为沉淀分离出来,至少需要加入 4mol/L NaOH溶液的体积为( )
A.40mL
B.72mL
C.80mL
D.128mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com