
| A. | 在离子化合物中,可能含共价键 | |
| B. | 在共价化合物中,可能含离子键 | |
| C. | 含共价键的化合物一定是共价化合物 | |
| D. | 含离子键的化合物不一定是离子化合物 |
分析 含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,据此分析解答.
解答 解:A.在离子化合物中一定含有离子键,可能含有共价键,如KOH等,故A正确;
B.只含共价键的化合物是共价化合物,所以共价化合物中一定不含离子键,故B错误;
C.含有共价键的化合物可能是离子化合物,如铵盐等,故C错误;
D.含有离子键的化合物是离子化合物,所以离子化合物一定含有离子键,故D错误;
故选A.
点评 本题考查化学键和化合物关系,为高频考点,明确物质构成微粒及微粒之间作用力即可解答,不能根据是否含有金属元素判断离子化合物,为易错点.


科目:高中化学 来源: 题型:多选题
| A. | 单位时间内生成amol O2的同时生成2amol NO的状态 | |
| B. | NO2、NO、O2三者物质的量之比为2:2:1的状态 | |
| C. | 混合气体的密度不随时间变化而变化的状态 | |
| D. | 混合气体的平均相对分子质量不随时间变化而变化的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (8)CH2=CH-CH3(9)
(8)CH2=CH-CH3(9) (10)2,2-二甲基丁烷.
(10)2,2-二甲基丁烷.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ③CH3CH2Br④
③CH3CH2Br④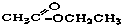 ⑤
⑤ ⑥
⑥
 ⑧
⑧ ⑨
⑨ ⑩
⑩
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨作电极电解AIC13溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H202+6H+═2Mn2++4O2↑+6H2O | |
| C. | 石灰水中加入过量小苏打溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 0.2 mol/L的NH4Al( SO4)2溶液与0.3 mol/L的Ba( OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学实验小组为探究氯气漂白原理,设计了以下实验装置:
某化学实验小组为探究氯气漂白原理,设计了以下实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
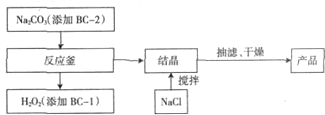
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com