
【题目】室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体![]() 在合适反应条件下,它们可以按下面框图进行反应;E溶液是无色溶液,F是淡绿色溶液
在合适反应条件下,它们可以按下面框图进行反应;E溶液是无色溶液,F是淡绿色溶液![]() 和C反应发出苍白色火焰
和C反应发出苍白色火焰![]() 请回答:
请回答:

(1)B是 ______ ,C是 ______ ![]() 请填写化学式
请填写化学式![]() ;
;
(2)反应![]() 的化学方程式 ______ ;
的化学方程式 ______ ;
【答案】Cl2 H2 2Fe+3Cl2 ![]() 2FeCl3
2FeCl3
【解析】
A是常见的金属单质、单质B是黄绿色气体,为氯气,单质C是无色气体,B和C反应发出苍白色火焰,说明C为氢气,则E为氯化氢,E溶液为盐酸,盐酸和A反应生成氢气和F,F为淡绿色溶液,说明为氯化亚铁,A为铁。D为氯化铁。
A是常见的金属单质、单质B是黄绿色气体,为氯气,单质C是无色气体,B和C反应发出苍白色火焰,说明C为氢气,则E为氯化氢,E溶液为盐酸,盐酸和A反应生成氢气和F,F为淡绿色溶液,说明为氯化亚铁,A为铁。D为氯化铁。
(1)B为氯气,Cl2,C为氢气,H2;
(2)反应![]() 的化学方程式为2Fe+3Cl2
的化学方程式为2Fe+3Cl2 ![]() 2FeCl3。
2FeCl3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)由N2、NO、CO2组成的混合气体中,三种成分的体积分数之比为1:2:1,则三种成分的质量比为________。
(2)等质量的钠和镁分别与足量的稀硫酸反应,放出气体的体积(同温同压)之比为________。
(3)同温同压下,某容器充满CO2重122 g,充满NO气体重115 g,现充满某气体B重123 g,则该气体的相对分子质量为_____。
(4)有15 g A物质和10.5 g B物质恰好完全反应生成7.2 g C物质、1.8 g D物质和0.3 mol E物质,则E物质的摩尔质量是_____g·mol-1。
(5)标准状况下,10 mL N2气体恰好与30 mL H2完全反应生成20 mL气体A,则A的分子式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:(8分钟时A为0.2mol 、B为0.5mol)
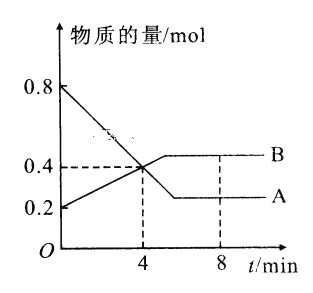
(1)该反应的化学方程式为_________________________。
(2)反应开始时至4min时,A的平均反应速率为________。
(3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>”“<”或“=”)。
II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。
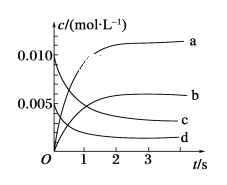
(3)能说明该反应已达到平衡状态的是________(填序号)。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d. 容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E和F加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)![]() G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
温度℃ | 25 | 80 | 230 |
平衡常数值 | 5×104 | 2 | 1.9× 10﹣5 |
A.上述反应是熵增反应
B.25℃时,反应G(g)![]() E(s)+4F(g)的平衡常数值是0.5
E(s)+4F(g)的平衡常数值是0.5
C.在80℃时,测得某时刻,F、G浓度均为0.5 mol·L﹣1,则此时v(正)>v(逆)
D.恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中钌(Ru)与铁相邻位于铁的下一周期,某钌光敏太阳能电池的工作原理如下图所示,图中RuII*表示激发态。下列说法正确的是

A. 电池工作时,直接将太阳能转化为电能
B. 理论上,n(被还原的I3-):n(被氧化的Ru II*)=1:2
C. 在周期表中,钌位于第五周期第ⅧB族
D. 电池工作时,正极的电极反应式为Ru3++e-=Ru2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 酸性溶液中KIO3与KI反应生成I2:IO![]() +I-+6H+===I2+3H2O
+I-+6H+===I2+3H2O
B. 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-===2BaSO4↓+Al(OH)3↓
C. 用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2===2NH4++SO32-+H2O
D. 用铜作电极电解CuSO4溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物的转化关系:C![]() CO2
CO2![]() H2CO3
H2CO3![]() CaCO3
CaCO3![]() CO2,其中涉及的基本反应类型依次是( )。
CO2,其中涉及的基本反应类型依次是( )。
A.化合、置换、分解、复分解
B.置换、复分解、化合、分解
C.置换、化合、复分解、分解
D.置换、化合、分解、复分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面为甲、乙、丙三位同学制取乙酸乙酯的实验过程。
(实验目的)制取乙酸乙酯。
(实验原理)甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
1.(装置设计)甲、乙、丙三位同学分别设计了下列三套实验装置:
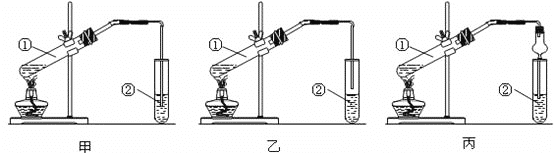
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,不应选择的装置是____(填“甲”或“乙”)。丙同学装置中的球形干燥管,除起冷凝作用外,另一重要作用是______。
2.(实验步骤)
(1)按选择的装置组装仪器,在试管中先加入amLCH3CH218OH(密度为ρg/cm-3)和过量的冰醋酸(CH3COOH),并边振荡边缓缓加入2mL浓H2SO4;
(2)将试管固定在铁架台上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时认为反应基本完成。
(问题讨论)
a.按步骤(1)装好实验装置,加入药品前还应______。
b.在(5)中,当观察到试管②中有______现象时认为反应基本完成。
c.分离试管②中的混合物可以得到产品及回收未反应的乙酸和乙醇,实验操作流程如下:
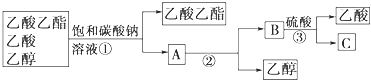
在上述实验操作流程中,所涉及的①②③三次分离操作分别是:______。
d.已知在酸与醇的酯化反应中,反应的原理是酸失去羟基,醇失去氢原子结合成水。请写出试管①中生成乙酸乙酯反应的化学方程式(注明反应条件)_____________。
最后得到纯净的乙酸乙酯bg,求本实验中乙酸乙酯的产率:______(用a、b、ρ表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了下图的实验装置。回答下列问题:

(1)①装置中仪器a的名称是____________________。
(2)写出装置①中反应方程式并标出双线桥____________________。
(3)装置②中饱和食盐水的作用是__________________________。
(4)装置③制取漂白粉的化学方程式是_____________。
(5)漂白粉的漂白原理是___________________________(用化学方程式表示)。
(6)化学实验中常用湿润的淀粉碘化钾试纸检验是否有Cl2产生,写出检验过程中发生的反应方程式 ______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com