
| A. | 略小于20% | B. | 略大于20% | C. | 20% | D. | 80% |
分析 硼元素的相对原子质量是10.8,再根据$\overline{M}$=$\frac{m}{n}$计算其物质的量之比,进而计算105B的质量分数.
解答 解:硼元素的相对原子质量是10.8,则硼元素的摩尔质量是10.8g/mol,
设10B和11B的物质的量分别是xmol、ymol,则$\frac{10x+11y}{x+y}$=10.8g,
解得x:y=1:4,
则105B的质量分数为$\frac{1mol×10g/mol}{5mol×10.8g/mol}$×100%=18.5%,
故选:A.
点评 本题考查物质的量的有关计算,掌握以物质的量为中心的计算,可以利用十字交叉法计算物质的量故选,题目难度不大.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 摩尔是一种国际基本物理量 | |
| B. | 1mol氢气的质量为1g | |
| C. | 在同温同压下,相同体积的任何气体所含分子数相同 | |
| D. | 标准状况下,1mol任何物质的体积都约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ |
| 分子式 | C9H12 | C3H7OCl | C5H12O |
| 限定条件 | 芳香烃 | 含有羟基 | 不能与Na反应放出氢气 |
| A. | ③②① | B. | ②③① | C. | ③①② | D. | ②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L溶液中有阴、阳离子总数为0.8NA | |
| B. | 2L溶液中硝酸根离子浓度为0.4 mol/L | |
| C. | 0.5L溶液中钡离子的浓度为0.2mol/L | |
| D. | 0.5L溶液中含有硝酸根离子的总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +(8-$\frac{2}{3}$m) | B. | +(8-2m) | C. | +(8-$\frac{3}{2}$m) | D. | +(8-3m) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肉桂酸(C6H5CH=CHCOOH)是一种常用的香料,可从桂皮中提取,还可用甲苯、氯气等为原料按如下路线合成:
肉桂酸(C6H5CH=CHCOOH)是一种常用的香料,可从桂皮中提取,还可用甲苯、氯气等为原料按如下路线合成: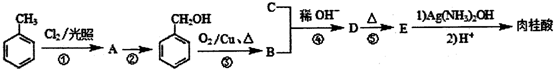
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2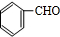 +2H2O.
+2H2O.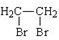
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
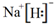 ,推测这种化合物具有较强的还原性.(填“氧化性”或“还原性”)
,推测这种化合物具有较强的还原性.(填“氧化性”或“还原性”)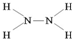 .W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为4Cu(OH)2+N2H4=2Cu2O+N2↑+6H2O.
.W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为4Cu(OH)2+N2H4=2Cu2O+N2↑+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com