
����Ŀ��Na2S2O5�dz��õķ�������Ư�����������̵����е�SO2����Na2S2O5�����������£�
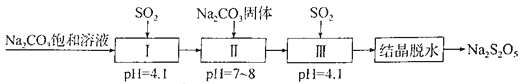
����˵����ȷ����
A. �����Ʊ��������漰��������ֻ��һ������������
B. Na2S2O5����������SO2��Ư��ʱ�������ֻ�ԭ��
C. ���������е�Na2CO3������Һ��Na2CO3���岻�ɻ���
D. ʵ����ģ�����ᾧ��ˮ��ʱ�õ�������ֻ���������������ձ���©��
���𰸡�C
��������
����̼������Һ��ͨ���������ʹ��ҺpH��Ϊ4.1��˵����Һ�����ԣ�Na2CO3�Լ��ԣ�Na2SO3�Լ��ԣ�NaHCO3�Լ��ԣ���NaHSO3�����ԣ�˵����Ӧ������NaHSO3��ͬʱ�ų�������̼��I�е���ҺӦΪNaHSO3��Һ���ټ���Na2CO3���壬��NaHSO3ת��ΪNa2SO3���ٴγ���SO2����Na2SO3ת��ΪNaHSO3���õ������͵�NaHSO3��Һ����NaHSO3��������Һ�ᾧ��ˮ�Ƶ�Na2S2O5������2NaHSO3�TNa2S2O5+H2O���ݴ˷������
A�������Ʊ��������漰����������2������������������������Ͷ�����̼����A����
B��SO2��Ư��ʱ��δ����������ԭ��Ӧ��û�б��ֻ�ԭ�ԣ���B����
C�������������������������е�Na2CO3������Һ��Na2CO3���岻�ɻ���������ò��������͵�NaHSO3��Һ����C��ȷ��
D�� ���ᾧ��ˮ���Ǽ��ȹ���ֽ⣬Ӧ���������н��У���D����
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��һ����Ҫ�Ļ���ԭ�ϣ����ɶ���������Ʊ����ش��������⣺
(1)������(C4H10)������1-��ϩ(C4H8)���Ȼ�ѧ����ʽ���£�
��C4H10(g)= C4H8(g) + H2(g) ��H1��֪����C4H10(g) +![]() O2(g)= C4H8(g) + H2O(g) ��H2=��119 kJ��mol-1��H2(g) +
O2(g)= C4H8(g) + H2O(g) ��H2=��119 kJ��mol-1��H2(g) + ![]() O2(g)= H2O(g) ��H3=��242kJ��mol-1.��Ӧ�ٵ���H1Ϊ_____ kJ��mol-1��ͼ(a)�Ƿ�Ӧ��ƽ��ת�����뷴Ӧ�¶ȼ�ѹǿ�Ĺ�ϵͼ��x_______0.1(��������������С����)����ʹ��ϩ��ƽ�������ߣ�Ӧ��ȡ�Ĵ�ʩ��_____(����)��
O2(g)= H2O(g) ��H3=��242kJ��mol-1.��Ӧ�ٵ���H1Ϊ_____ kJ��mol-1��ͼ(a)�Ƿ�Ӧ��ƽ��ת�����뷴Ӧ�¶ȼ�ѹǿ�Ĺ�ϵͼ��x_______0.1(��������������С����)����ʹ��ϩ��ƽ�������ߣ�Ӧ��ȡ�Ĵ�ʩ��_____(����)��
A�������¶� B�������¶� C������ѹǿ D������ѹǿ

(2)����������Ļ��������һ������ͨ������д����ķ�Ӧ��(�����������ǻ����)���������к��ж�ϩ�����顢�����ȡ�ͼ(b)Ϊ��ϩ�������������n(����)/n(����)�Ĺ�ϵ��ͼ�����߳��������ߺ͵ı仯���ƣ��併�͵�ԭ����______________________��
(3)ͼ(c)Ϊ��Ӧ���ʺͷ�Ӧ�¶ȵĹ�ϵ���ߣ���������Ҫ�Ǹ����ѽ����ɵĶ�̼��������590 ��֮��ϩ���ʿ��ٽ��͵���Ҫԭ����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������A��F��������Ϥ�ĵ��ʻ������A��B���dz����Ľ�������B�ĺϽ��������E�ڳ������ǻ���ɫ���壻�ʵ��������£�����֮����Է�����ͼ��ʾ��ת����

��1��G��Һ�����ʵĻ�ѧʽΪ_____________��
��2����д����ӦD��F�Ļ�ѧ����ʽ��_________��
��3������F�н��������ӵij����Լ���______________�������ʵĻ�ѧʽ����������____________��
��4��E���ʿ���ʯ���鷴Ӧ��ȡƯ�ۣ�д��Ư�۵���Ч�ɷ�_________��
��5��д��C���������������Һ��Ӧ�����ӷ���ʽ_______________��
��6������D��Һ�еμ�����������Һ�������ǣ�____����Ӧ�����еĻ�ѧ����ʽΪ��____��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��Ŀ����Դ�ḻ������ijұ������(��Ҫ�ɷ�Ϊ�������������ͭ��Ǧ������������)��������ͭ��Ǧ�Ĺ�����������ͼ��ʾ:

�ش��������⣺
��1����¯ұ��ʱ����̿��������________(������������������ԭ����)������̿�����Ŀ����__________���ۼ�����Ҫ�ɷ��Ƿ�ʯ(CaF2)������������SiO2��Ӧ�������ָ��Σ�����֮һΪ CaSiF6���÷�Ӧ�Ļ�ѧ����ʽΪ____________________________��![]()
��2�����������Һ�к���������Sn2+��Ϊ����������ʧ����������ͭ��Ǧ������Ԫ�Ͻ���մ�������Ӧ�����ӷ���ʽΪ____________________________��
��3����֪SnO2������ϡ���ᡣ�������������յ�Ŀ����__________________��
��4�����CuSO4��Һʱ�������ĵ缫��ӦʽΪ___________________________��
��5����֪H2CO3��һ���������볣���ֱ�ΪK1��K2��PbSO4��PbCO3���ܶȻ������ֱ�ΪKsp(PbSO4)��Ksp(PbCO3)������Ǧ���е�Ǧ��Ҫ��PbSO4���ڣ�����ʱ�����ķ�ӦΪ��
PbSO4(s)+HCO3��(aq) ![]() PbCO3(s)+H+(aq)+SO42-(aq)���÷�Ӧ��ƽ�ⳣ��K=___________(��������֪������ʾ)�����������ˡ�ϴ���ٽ�����һ�������������Ƿ�ϴ�Ӹɾ��ķ�����_____________________________��
PbCO3(s)+H+(aq)+SO42-(aq)���÷�Ӧ��ƽ�ⳣ��K=___________(��������֪������ʾ)�����������ˡ�ϴ���ٽ�����һ�������������Ƿ�ϴ�Ӹɾ��ķ�����_____________________________��
��6������ұ��������������������Ϊ5%��30t�����Ƶþ���lt�������Ļ�����Ϊ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���д�����ǣ� ��
A.��A��g��+B��g��![]() C��g����H��0��������Ӧ�Ļ��С���淴Ӧ�Ļ��
C��g����H��0��������Ӧ�Ļ��С���淴Ӧ�Ļ��
B.�Ʊ���������ʱ�����ȵ�NaOH��Һ�ռ������Գ�ȥ���е�����
C.�����������Ӧ�뱽�����ᷴӦ�����������ķ�Ӧ������ͬ
D.��֪ij�¶���Ksp��Ag2S��=6��10һ50��Ksp��AgC1���T2��l0һ10����2AgCl��s��+S2����aq��![]() Ag2S��s��+2C1����aq����ƽ�ⳣ��ԼΪ6.7��1029
Ag2S��s��+2C1����aq����ƽ�ⳣ��ԼΪ6.7��1029
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��IUPAC����117��Ԫ��ΪTs����������![]() ����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ����
����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ����
A.Ts�ǵ������ڵڢ�A��Ԫ��
B.Ts��ͬλ��ԭ�Ӿ�����ͬ�ĵ�����
C.Ts��ͬ��Ԫ���зǽ���������
D.������Ϊ176��Ts���ط�����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݵ���������Ӧ���Ȼ�ѧ����ʽ (i)I2(g)+H2(g)![]() 2HI(g) ��H=" -" 9.48kJ/mol ��(ii) I2(s)+H2(g)
2HI(g) ��H=" -" 9.48kJ/mol ��(ii) I2(s)+H2(g)![]() 2HI(g) ��H=" +" 26.48kJ/mol�������ж���ȷ����
2HI(g) ��H=" +" 26.48kJ/mol�������ж���ȷ����
A. 254g I2(g)��ͨ��2g H2(g)����Ӧ����9.48 kJ
B. 1 mol��̬����1mol��̬���������������l7.00 kJ
C. ��Ӧ(i)�IJ���ȷ�Ӧ(ii)�IJ����ȶ�
D. ��Ӧ(i) ��1mol I-I����1mol H-H����Ҫ��������С�ڲ�2mol H-I����Ҫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ģ�������������ˮ�����Ĺ���ԭ��ʾ��ͼ���¡���֪X��Y��Ϊ���Ե缫��ģ�⺣ˮ�и���Na+��Cl����Ca2+��Mg2+��SO42�������ӡ���������������ȷ����

A��N�������ӽ���Ĥ
B��Y�缫�ϲ�����ɫ����
C��X�缫�����л��Dz���
D��X�缫��ӦʽΪ4OH����4e����O2��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��������A�е�Ũ����μӵ�ʢ��MnO2����ƿ�У����Ⱥ��������������ͨ��װ��B��C��Ȼ����ͨ�����ȵ�ʯӢ������D (���������� )����ش�
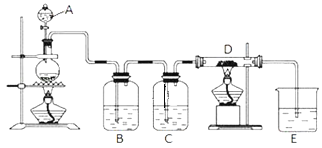
(1)��ƿ�з�Ӧ�Ļ�ѧ����ʽ��_____��
(2)װ��B��ʢ��Һ����_____������ͨ��װ��B��Ŀ����_____��װ��C��ʢ�ŵ�Һ����_____������ͨ��װ��C��Ŀ����_____��
(3)�ձ�E��ʢ�ŵ�Һ����_____��
(4)���ϱ���D�в������������ʣ�����������������ȴ��������������H2O (g )���ҷ�Ӧ��Ϊ�ռ�D�в����D��E֮�䣬�������ռ�װ���⣬����Ҫ����_____װ�ã�
(5)������ת�Ƶ���ĿΪ6.02��1023��ʱ���ɵ����������ʵ���Ϊ_____mol�����ɵ���������0.5mol/L��NaOH��Һ_____L��ȫ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com