
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
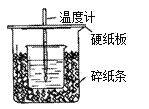
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________。
(2)烧杯间填满碎纸条的作用是_______________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1的盐酸跟50 mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热_____________ (填“相等”或“不相等”)。
(5)此反应中和热的热化学方程式为:________________________________________。
【答案】 环形玻璃搅拌棒 减少实验过程中的热量损失 偏小 不相等 相等 NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) ΔH= -57.3 kJ/mol
【解析】(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒。(2)实验过程中尽可能减少热量的损失,因此烧杯间填满碎纸条的作用是减少实验过程中的热量损失。(3)大烧杯上如不盖硬纸板,热量散失,求得的中和热数值偏小。(4)如果实验中改用60 mL0.50 mol·L-1的盐酸跟50mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,生成水的物质的量增加,所放出的热量不相等;中和热是强酸、强碱生成1mol水所对应的反应热,因此所求中和热相等。(5)表示中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=-57.3 kJ/mol。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是
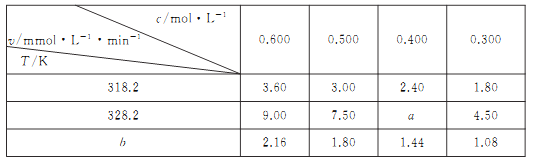
A. a=6.00 B. 同时改变反应温度和蔗糖的浓度,v可能不变
C. b>318.2 D. 不同温度时,蔗糖浓度减少一半所需的时间不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄酮醋酸(F)具有独特抗癌活性,它的合成路线如下:

已知:RCN在酸性条件下发生水解反应:RCN![]() RCOOH
RCOOH
(1)C的分子式为_______________,D→E的反应类型是________________。
(2)F分子中有3个含氧官能团,名称分别为醚键、羧基和______________。
(3)写出A→B 的化学方程式:__________________________________。
(4)E在酸性条件下水解的产物可通过缩聚反应生成高分子化合物,该高分子化合物的结构简式为________________。
(5)写出符合下列条件的D的一种同分异构体的结构简式:________________。
①分子中有4种不同化学环境的氢;
②可发生水解反应,且一种水解产物能与FeCl3发生显色反应,另一种水解产物能发生银镜反应。
(6)对羟基苯乙酸乙酯(![]() )是一种重要的医药中间体。写出以
)是一种重要的医药中间体。写出以![]() 和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: _______。
_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 电解熔融NaCl:2Cl-+2H2O ![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B. 用氨水溶解AgCl沉淀:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
C. Na2CO3溶液吸收溴蒸气:3CO32-+Br2=Br-+BrO3-+3CO2
D. 金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列反应的焓变
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) △H2=-393.5kJ/mol
③2H2(g)+O2(g) =2H2O(l) △H3=-285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=_____________kJ/mol。
(2)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:_________________________。
(3)火箭推进器常以气态联氨(N2H4)为燃料、液态过氧化氢为助燃剂进行热能提供.反应过程中生成的气体可参与大气循环。测得当反应过程中有1mol水蒸气生成时放出161kJ的热量.试写出反应过程中的热化学方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是:
A. NH3 + HCl = NH4Cl B. CuO + H2![]() Cu + H2O
Cu + H2O
C. CaCO3 ![]() CaO + CO2↑ D. H2SO4 + 2NaOH = Na2SO4 + 2H2O
CaO + CO2↑ D. H2SO4 + 2NaOH = Na2SO4 + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是中学化学中常见且重要的一类反应,回答下列问题:
(1)下列金属单质参加的化学反应都是氧化还原反应,都是金属失电子。
①相同质量的钠分别与氧气反应,全部生成氧化钠和全部生成过氧化钠两种情况下转移的电子数目之比是________;
②分别取W克钠、铁、铝与足量的盐酸反应,失去电子的物质的量之比是________;③分别取含0.1mol H2SO4的稀硫酸和含0.1mol NaOH的氢氧化钠溶液于两支试管中,分别加入足量的铝粉充分反应,产生氢气 (同温同压下)的体积之比是________。
(2)某氧化还原反应的反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2转化为氧气。
①该反应中的还原剂是____________;
②如果化学方程式中Cr(OH)3和H2O2的物质的量之比为2:3,写出该反应的化学方程式,并标出电子转移的方向和数目_________________;
③如果反应中转移了3a mol电子,则产生的气体在标准状况下体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2→O2。
(1)该反应中的还原剂是____。
(2)该反应中,发生还原反应的过程是_____→_____。
(3)写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目_____________________。
(4)如反应转移了0.4mol电子,则产生的气体在标准状况下体积为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氯、钠、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态氯原子的价电子排布图是________________________;基态铜原子核外电子占有的空间运动状态有____________种
(2)碳、氮、氧三种元素中第一电离能最大的是____________ (填元素符号)CO32-中碳原子的杂化轨道类型为____________。
(3)相同条件下,水的沸点高于液氨,原因是________________________。
(4)铜与CNˉ可形成络合离子[Cu(CNˉ)4]2-,写出一种与CNˉ互为等电子体的分子的化学式____________;1 mol[ Cu(CNˉ)4]2-中含有____________molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为_________。
(5)氯化钠的晶胞如图所示。晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中。一个氯离子周围离氯离子最近的氯离子数目为__________个。已知:半径r(Clˉ)=apm,r(Na+)=bpm。摩尔质量M(NaCI)=cg·mol-1则氯化钠晶体的密度为_________g·cm-3

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com