(1)已知aA+,bB2+,cC-,dD2-四种离子具有相同的电子层结构,则a、b、c、d由大到小的顺序为: ;
(2)某元素的一种同位素R原子的质量数为A,含N个中子,它与1H原子组成HyR分子,则R原子的最外层电子数为 ,在ag 1HyR分子中含质子的物质的量是 mol;
(3)已知14mol/L 的硫酸溶液的溶质质量分数为80%,则7mol/L 的硫酸溶液的溶质质量分数 40%(填大于、小于、等于).
【答案】
分析:(1)根据离子中质子数=电子数与电荷数之间的关系判断.
(2)根据主族元素的最低负价与最外层电子数之间的关系判断;先计算一个分子中含有的质子数,再根据质量、摩尔质量、每个分子含有的质子数之间的关系判断.
(3)根据物质的量浓度与密度、质量分数之间的关系判断.
解答:解:(1)阳离子中,质子数=核外电子数+电荷数,四种离子具有相同的电子层结构,所以核外电子数相同,设核外电子数为X,所以
aA
+,
bB
2+的质子数分别为:a=X+1;b=X+2;
阴离子中,质子数=核外电子数-电荷数,所以
cC
-,
dD
2-的质子数分别为:c=X-1; d=X-2;
故答案为:b、a、c、d.
(2)元素的最低负价与最外层电子数之间的关系是:最低负价=最外层电子数-8,H
yR中R的化合价是-y,所以其最外层电子数为8-y;
R原子中质量数为A,中子数为N,所以其质子数为A-N;一个
1H
yR分子中含质子数为:A-N+y,ag
1H
yR的物质的量
为:

mol,所以ag
1H
yR分子中含质子的物质的量为:
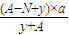
mol,
故答案为:8-y;
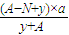
mol.
(3)根据

,得
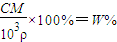
,溶质相同,所以M相同,所以质量分数与溶液的物质的量浓度成正比,与密度成反比,浓度越大,密度越大,所以7mol/L 的硫酸溶液的溶质质量分数大于14mol/L 硫酸溶液的溶质质量分数的一半,故答案为:大于.
点评:本题考查学生分析问题、解决问题的能力,知道溶液的密度随溶液的物质的量浓度的变化而变化是解(3)题的关键.有些溶液随物质的量浓度的增大而增大,如硫酸溶液;有些溶液的密度随溶液的物质的量浓度的增大而减小,如氨水溶液.

 mol,所以ag 1HyR分子中含质子的物质的量为:
mol,所以ag 1HyR分子中含质子的物质的量为: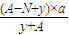 mol,
mol,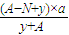 mol.
mol. ,得
,得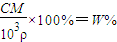 ,溶质相同,所以M相同,所以质量分数与溶液的物质的量浓度成正比,与密度成反比,浓度越大,密度越大,所以7mol/L 的硫酸溶液的溶质质量分数大于14mol/L 硫酸溶液的溶质质量分数的一半,故答案为:大于.
,溶质相同,所以M相同,所以质量分数与溶液的物质的量浓度成正比,与密度成反比,浓度越大,密度越大,所以7mol/L 的硫酸溶液的溶质质量分数大于14mol/L 硫酸溶液的溶质质量分数的一半,故答案为:大于.
