
分析 影响化学反应速率的因素有内因和外因,内因为物质的性质,为主要因素,常见影响化学反应速率的外因有浓度、温度、压强、催化剂以及固体的表面积等,一般来说浓度越大、温度越高、压强越大以及增大固体表面积、加入催化剂等,都可增大反应速率,以此解答.
解答 解:(1)盐酸的浓度不同,为影响反应速率的主要因素,浓度越大,反应速率越大,故答案为:反应物的浓度;
(2)黄铁矿煅烧时要粉碎成细小的矿粒,固体表面积增加,则反应速率增大,故答案为:反应物的接触面积;
(3)在溶液中,水作溶剂,增大了接触面积,加快了反应速率,所以若一起投入水中,很快生成红色HgI2,故答案为:在溶液中,水作溶剂,增大了接触面积;
(4)MnO2为该反应的催化剂,可加快反应速率,故答案为:催化剂;
(5)锌与镁的活动性顺序不同,与盐酸反应的剧烈程度不同,故答案为:物质的性质.
点评 本题考查化学反应素的影响因素,为高频考点,侧重于学生的分析能力和基本概念、理论知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 用酸性KMnO4溶液鉴别乙烯和乙炔 | |
| B. | 苯和浓溴水反应制溴苯 | |
| C. | CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 | |
| D. | 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯及其化合物在合成消毒剂、药物等方面具有广泛用途.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,某兴趣小组通过如图装置,对二氧化氯及氯气的性质进行了研究:
氯及其化合物在合成消毒剂、药物等方面具有广泛用途.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,某兴趣小组通过如图装置,对二氧化氯及氯气的性质进行了研究:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的结构式: | |
| B. | 次氯酸的结构式为:H-Cl-O | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p6 | |
| D. | NH3的电子式: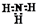 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
;
 ②H2O22H•+2
②H2O22H•+2 →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>W>Z | B. | 原子序数:d>c>b>a | ||
| C. | 离子半径:Z3->W->Y+>X2+ | D. | 原子的最外层电子数目:X>Y>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com