
| A. | 氯气和二氧化硫都能使品红溶液褪色 | |
| B. | 异戊烷和异戊二烯都能使溴水层褪色 | |
| C. | 亚硫酸钠和乙烯都能使酸性高锰酸钾溶液褪色 | |
| D. | 活性炭与氢氧化钠溶液都能使二氧化氮气体褪色 |
分析 A.二氧化硫与品红化合生成无色物质,而氯气与水反应生成的HClO,具有强氧化性;
B.烷烃与溴水不反应,烯烃能与溴水发生加成反应;
C.亚硫酸钠和乙烯都能被酸性高锰酸钾氧化;
D.活性炭具有吸附性,氢氧化钠与二氧化氮发生化学反应.
解答 解:A.二氧化硫与品红化合生成无色物质,而氯气与水反应生成的HClO,具有强氧化性使品红褪色,则原理不同,故A错误;
B.烷烃与溴水不反应,使溴水褪色是发生了萃取,烯烃能与溴水发生加成反应,原理不同,故B错误;
C.亚硫酸钠和乙烯都具有还原性,能被酸性高锰酸钾氧化,所以原理相同,故C正确;
D.活性炭具有吸附性,使二氧化氮气体褪色是物理变化,氢氧化钠与二氧化氮发生化学反应,原理不同,故D错误;
故选:C.
点评 本题考查了元素化合物知识,熟悉二氧化硫的性质是解题关键,注意蛋白质的盐析与变性的区别,侧重于考查学生的分析能力,题目难度不大.


科目:高中化学 来源: 题型:解答题
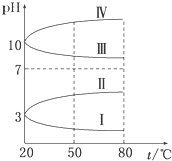 NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨是非电解质,但液态氯化氢是强电解质 | |
| B. | 体积不同但pH相同的醋酸和盐酸,用蒸馏水分别稀释至原体积的m倍和n倍后两溶液的pH值仍相同,m和n的相对大小无法确定 | |
| C. | CuCl2+2H2O═Cu(OH)2+2HCl,加入少量硝酸银固体后可以增大CuCl2水解程度 | |
| D. | I-、K+、Na+、NO3-、Cl-一定可以在甲基橙呈黄色的溶液中大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
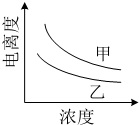 结合下表回答下列问题(均为25℃时的数据)
结合下表回答下列问题(均为25℃时的数据)| 酸 | 电离平衡常数(Ka) | 酸 | 电离平衡常数(Ka) |
| CH3COOH | 1.7×10-5 | H3BO3 | 5.8×10-10 |
| H2CO3 | Ka1=4.2×10-7 Ka2=5.6×10-11 | HNO2 | 7.1×10-4 |
| HCN | 6.2×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入甲烷的电极为电池的负极,通入氧气的电极为正极 | |
| B. | 在标准状况下,每消耗5.6 L O2,可向外提供2.4×104 C的电量 | |
| C. | 通入甲烷电极的电极反应为:CH4+10OH--8e-═CO32-+7H2O | |
| D. | 放电一段时间后,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知FeO4n-中Fe的化合价是+6价,则n=2 | |
| B. | 每产生1molCl-,转移2mol电子 | |
| C. | FeO4n-具有强氧化性,一般其还原产物为Fe3+,可用作新型自来水消毒剂和净水剂 | |
| D. | 若n=2,则该反应中氧化剂与还原剂的物质的量之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42- | B. | NO3- | C. | SCN- | D. | CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com