
(15分)氧化还原反应在生产、生话中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂。用所学知识同答问题:
(1)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为 ,反应中消耗1mol的MnO—4时转移电子数为 。
(2)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(3)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474g KMnO4样品溶解酸化后,用0.100mol/L标准Na2S2O3溶液进行滴定,滴定至终点的现象是 。实验中,滴定至终点时消耗Na2S2O3溶液12.00mL,则该样品中KMnO4的纯度是 。(有关离子方程式为:8MnO—4+5S2O2—3+14H+=8Mn2++10SO2—4+7H2O
(4)Mg—H2O2酸性电池采用海水作龟解质溶液(加入一定量的稀硫酸),该电池的负极材料是
___,正极的反应式为 。
(5)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是____ ,又变为棕黄色的原因是 。
(15分)
(1)2KMnO4+5H2C2O4+ 3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O(2分) 3.01×1024(或答5NA也给分,2分)
(2)0.032(2分)
(3)紫红色溶液褪为无色,且30秒内颜色不再变化(1分) 64%(或0.64)(2分)
(4)镁(1分) H2O2+2H++2e-=2H2O(2分)
(5)2Fe3+ + SO32- + H2O = 2Fe2+ + SO42- + 2H+(2分) H+与NO3-组成的硝酸把Fe2+氧化(1分)
【解析】
试题分析:在稀硫酸中,KMnO4能将H2C2O4氧化为CO2,而本身被还原为硫酸锰,根据H、K元素守恒可知,产物中有水、硫酸钾生成,所以化学方程式为2KMnO4+5H2C2O4+ 3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O;Mn元素的化合价从+7价降为+2价,所以1mol高锰酸钾参加反应时转移电子的物质的量是5mol,电子数目是5NA=3.01×1024;
(2)根据题意高锰酸钾氧化KI为I2和KIO3,已知I元素的物质的量是0.3L×0.2mol/L=0.06mol,则I2和KIO3的物质的量均为0.02mol,共失去电子的物质的量是0.02mol×2×[0-(-1)]+0.02mol×[5-(-1)]=0.16mol,而Mn元素的化合价从+7价降为+2价,根据得失电子守恒规律,有(7-2)×n(KMnO4)=0.16mol,n(KMnO4)=0.032mol。
(3)高锰酸钾溶液为紫色溶液,当达到滴定终点时,溶液的紫色褪去且半分钟内不恢复;根据8MnO—4+5S2O2—3+14H+=8Mn2++10SO2—4+7H2O,可知高锰酸钾的物质的量是0.012L×0.100mol/L×8/5=0.00192mol,该样品中KMnO4的纯度是0.00192mol×158g/mol/0.474g×100%=64%;
(4)Mg—H2O2酸性电池中Mg的还原性强,所以 Mg发生氧化反应,作电池的负极,正极是过氧化氢发生还原反应结合电解质溶液生成水,电极反应式为H2O2+2H++2e-=2H2O;
(5)溶液由黄色变为浅绿色是因为硝酸铁与亚硫酸钠发生氧化还原反应,铁离子被还原为亚铁离子的缘故,离子方程式为2Fe3+ + SO32- + H2O = 2Fe2+ + SO42- + 2H+;后溶液又变黄色,是因为反应后的溶液显酸性,氢离子与硝酸根离子把亚铁离子又氧化为铁离子。
考点:考查常见氧化剂的性质的应用,氧化还原反应的判断与计算,离子方程式的书写,


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源:2015届福建省高三上学期半期联考化学试卷(解析版) 题型:选择题
在aLAl2(SO4)3和(NH4)2SO4的混合物溶液中加入b molBaCl2,恰好使溶液中的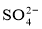 离子完全沉淀;若加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子物质的量浓度(mol/L)为
离子完全沉淀;若加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子物质的量浓度(mol/L)为
A.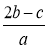 B.
B.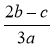
C.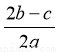 D.
D.
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三9月月考化学试卷(解析版) 题型:填空题
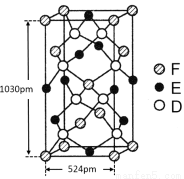
【化学选修3 物质结构与性质】(16分)
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族。 E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 ;
(2)E2+离子的价层电子排布图是 ,F原子的电子排布式是 ;
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的VSEPR模型为 ;
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子为 ;
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程为 ;
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:
d= g/cm3。
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三9月月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在pH=1的溶液中:K+、Na+、SO42–、HCO3-
B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42–
C.在0.1 mol·L-1 FeCl3溶液中:K+、NH4+、I-、SCN-
D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三10月月考理综化学试卷(解析版) 题型:填空题
【化学——选修4 有机化学基础】(15分)
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):
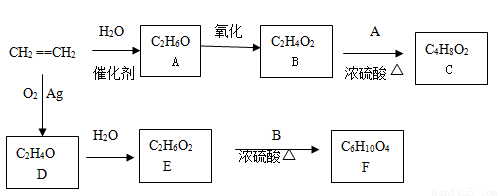
请回答下列问题:
(1)写出A在实验室制乙烯的方程式: 。
(2)B和E反应生成F的化学方程式为______ _____,该反应的类型为_____________;
(3)D的结构简式为____ _______;
(4)写出D的同分异构体(含醛基)发生银镜反应的化学方程式:
(5)C的同分异构体中含醛基的结构有 种。
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三上学期第二次检测考试化学试卷(解析版) 题型:填空题
(18分)C、O、Na、Al、S、Cl是常见的六种元素
(1)C元素位于元素周期表第 周期,第 族;C元素的一种同位素可以测定文物年代,这种同位素的符号为
(2)用“大于”“小于”或“等于”填空
离子半径 | 还原性 | 得电子能力 |
N3- Al3+ | O2- S2- | 35Cl 37Cl |
(3)① CaCO3和适量HCl溶液反应时,每产生4.4 g 气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为 。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示


请用离子方程式表示B-C段发生的反应:
(4)氢气、氧气常用来作燃料电池,写出电解质为氢氧化钠溶液时负极上的电极方程式
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三上学期第二次检测考试化学试卷(解析版) 题型:选择题
下列各溶液中,一定能大量共存的是
A.Fe3+、Na+、SO42-、H2O2 B.C2H5OH、MnO4-、H+ 、K+
C.Pb2+、K+ 、SO42-、Cl- D.Na+、SO32- 、CH3COO-、AIO2-
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高三第一次诊断考试化学试卷(解析版) 题型:选择题
一定能在下列溶液中大量共存的离子组是
①含有大量Al3+的溶液中:Na+、NH4+、SO42—、Cl-
②加入Al能放出H2的溶液中:Cl-、HCO3—、SO42—、NH4+
③含有大量Fe3+的溶液中:Na+、Mg2+、NO3—、SCN-
④在含有大量AlO2—的溶液中:NH4+、Na+、Cl-、H+
⑤由水电离出的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3—
A.①② B.①③⑤ C.① D.①④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com