
【题目】已知0.1molL﹣1的醋酸溶液中存在电离平衡:CH3COOHCH3COO﹣+H+ , 要使溶液中 ![]() 的值增大,可以采取的措施是( ) ①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水.
的值增大,可以采取的措施是( ) ①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水.
A.①②
B.①③
C.②④
D.③④
【答案】C
【解析】解:① ![]() =
= ![]() ,加少量烧碱溶液,溶液的酸性减弱,使醋酸的电离平衡正向移动,c(CH3COO﹣)增大,
,加少量烧碱溶液,溶液的酸性减弱,使醋酸的电离平衡正向移动,c(CH3COO﹣)增大, ![]() 值减小,故①错误;②弱电解质的电离过程是吸热的,升高温度促进电离,溶液中c(H+)增大,c(CH3COOH)降低,
值减小,故①错误;②弱电解质的电离过程是吸热的,升高温度促进电离,溶液中c(H+)增大,c(CH3COOH)降低, ![]() 值增大,故②正确;③
值增大,故②正确;③ ![]() =
= ![]() ,加少量冰醋酸,使醋酸的电离平衡正向移动,c(CH3COO﹣)增大,
,加少量冰醋酸,使醋酸的电离平衡正向移动,c(CH3COO﹣)增大, ![]() 值减小,故③错误;④
值减小,故③错误;④ ![]() =
= ![]() ,加水促进电离,溶液中n(H+)增大,n(CH3COOH)降低,
,加水促进电离,溶液中n(H+)增大,n(CH3COOH)降低, ![]() 值增大,故④正确;故选C.
值增大,故④正确;故选C.
【考点精析】认真审题,首先需要了解弱电解质在水溶液中的电离平衡(当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理).


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】下列物质中均为化合物的一组是
A. 金刚石、干冰、SO2 B. KCl、盐酸、NaOH
C. CuSO4·5H2O、冰、乙醇 D. 臭氧、CaCO3、铝合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
肼是一种高能燃料.已经各共价键键能(断裂或形成1mol共价键时吸收或释放的能量)如下:
N≡N | O=O | N﹣N | N﹣H | O﹣H | |
键能(KJmol﹣1) | 946 | 497 | 154 | 391 | 463 |
(1)N2H4(g)+O2(g)N2(g)+2H2O(l)△H=KJmol﹣1
(2)Ⅱ.密闭容器中进行反应:3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g)△H<02反应的化学平衡表达式为K= .
(3)已知:600℃时,上述反应的平衡常数K=16.现有如图1甲(恒温恒压)和如图1乙(恒温恒容)两容器,起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡.
Fe | H2O(g) | Fe3O4 | H2 | |
甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |
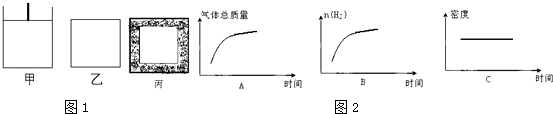
①关于甲、乙容器,下列说法正确的是
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4 , 两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=
③平衡后若将乙容器体系温度突然降低100℃,如图2下述图象中能正确反映平衡移动过程中容器内变化情况的是 .
(4)为恒容绝热容器,进行上述反应,起始与平衡时的各物质的量见下表:
Fe | H2O(g) | Fe3O4 | H2 | |
起始/mol | 3.0 | 3.0 | 0 | 0 |
平衡/mol | m | n | p | q |
若在达到平衡后的容器丙中,分别按照下列A、B、C三种情况继续添加各物质,则再次达平衡时,容器丙中H2的百分含量按由大到小的顺序(用A、B、C表示).
Fe | H2O(g) | Fe3O4 | H2 | |
A/mol | 3.0 | 3.0 | 0 | 0 |
B/mol | 0 | 0 | 3.0 | 3.0 |
C/mol | m | n | p | q |
25℃时,Fe(OH)3的ksp=4ⅹ10﹣38 , 现有盐酸酸化的0.08mol/L的FeCl3溶液,其PH=1,向其中加入等体积的mol/L的NaOH溶液,可恰好开始析出沉淀(混合时溶液体积可直接加和).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:(要写计算过程)
(1)NO的体积为 _L,NO2的体积为 _L;(保留2位有效数字)
(2)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法中正确的是( )
A.1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA
B.由2H和18O所组成的水11 g,其中所含的中子数为4NA
C.常温下丁烯和环丙烷组成的42 g混合气体中H原子数为6NA
D.1 mol FeI2与足量氯气反应时转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某气态平衡体系的平衡常数表达式为K= ![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K一定增大
B.增大A浓度,平衡向正反应方向移动
C.增大压强,C体积分数增加
D.升高温度,若B的百分含量减少,则正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 蔗糖和麦芽糖均为双糖
B. 酶是一类具有高选择催化性能的蛋白质
C. 植物油含不饱和脂肪酸酯,能使Br2/CCl4褪色
D. 淀粉和纤维素水解的最终产物均为葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据实验数据,写出下列反应的热化学方程式.
(1)1mol H2(g)与适量O2(g)反应,生成H2O(1),放出285.8kJ热量. .
(2)1mol C2H5OH(1)与适量O2(g)反应,生成CO2(g)和H2O(1),放出1366.8kJ热量. .
(3)2mol Al(s)与适量O2(g)发生反应,生成Al2O3(s),放出1669.8kJ热量. .
(4)已知2.00g C2H2气体完全燃烧生成液态水和CO2 , 放出99.6kJ的热量,写出表示C2H2燃烧热的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某单官能团有机化合物只含碳、氢、氧三种元素,相对分子质量为88,完全燃烧时产生的CO2和H2O的物质的量之比为5:6.该有机物能被氧化为对应的羧酸,它可能的结构共有( )
A.4种
B.5种
C.6种
D.7种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com