
| A. | C30H50 | B. | C30H56 | C. | C36H72 | D. | C30H60 |
科目:高中化学 来源: 题型:解答题
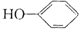 合成
合成 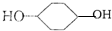
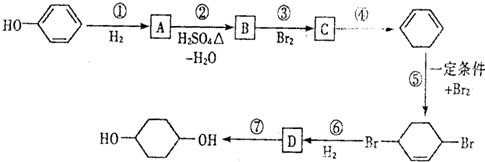
 ,D
,D .
.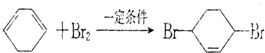 写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学反应方程式
写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学反应方程式 .
. 的反应方程式(有机物写结构简式,注明反应条件).
的反应方程式(有机物写结构简式,注明反应条件). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
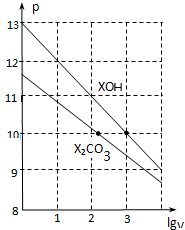
| A. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| B. | 已知常温下,0.1 mol•L-1 XHCO3溶液的pH=8.31,则Ka1(H2CO3)•Ka2(H2CO3)>Kw | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
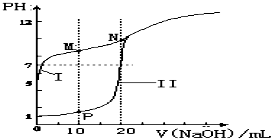 在弱电解质溶液中存在电离平衡,试回答下列问题.
在弱电解质溶液中存在电离平衡,试回答下列问题.| n(SO32-):n(HSO3-) | 91:1 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
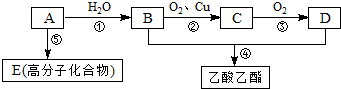
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 是一种抗氧化药物,存在如图所示的转化关系.
是一种抗氧化药物,存在如图所示的转化关系.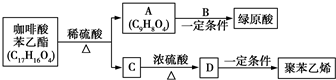
 .
.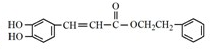 .
. (任写1个).
(任写1个).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与氢氧化钠反应:H++OH-═H2O | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | |
| D. | 碳酸钠与盐酸反应:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com