
【题目】(1)请用序号填空:
①13C与14C ②正丁烷与异丁烷
③CH3CH3与CH3CH2CH3 ④![]()
属于同位素的是______;属于同系物的是______;属于同分异构体的是______。
(2)写出下列物质的电子式:
NaCl____________ NH3______________
(3)第三周期元素中的最高价氧化物对应的水化物中,酸性最强的是______,碱性最强的是___________,呈两性的氢氧化物是___________。半径最大的原子是___________,氢化物最稳定的元素是__________。
(4)1molN2(g)与适量O2(g)反应生成NO(g),需吸收68kJ的热量,写出该反应的热化学方程式______________________;
【答案】① ③ ② ![]()
 HClO4 NaOH Al(OH)3 Na Cl N2(g) + O2(g) =2NO(g)ΔH=+68kJ/ mol
HClO4 NaOH Al(OH)3 Na Cl N2(g) + O2(g) =2NO(g)ΔH=+68kJ/ mol
【解析】
(1)①13C与14C都是碳元素的不同核素,属于同位素;
②正丁烷与异丁烷分子式相同,结构不同,属于同分异构体;
③CH3CH3与CH3CH2CH3结构相似,都是烷烃,在分子组成上相差一个“-CH2-”原子团,二者互为同系物;
④![]() 分子式相同,分子结构中的两个氯原子在空间上都处于邻位,结构也相同,属于同种物质;
分子式相同,分子结构中的两个氯原子在空间上都处于邻位,结构也相同,属于同种物质;
属于同位素的是①;属于同系物的是③;属于同分异构体的是②;
(2)NaCl属于离子化合物,由钠离子和氯离子构成,电子式为![]() ;NH3是共价化合物,电子式为
;NH3是共价化合物,电子式为 ;
;
(3)同周期元素随核电荷数增大,非金属性越强,金属性逐渐减弱,最高价氧化物对应的水化物的酸性越强,碱性逐渐减弱,第三周期非金属性最强的为Cl元素,则最高价氧化物对应的水化物的酸性最强的是HClO4,第三周期金属性最强的元素为Na,则最高价氧化物对应的水化物的碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3。同周期元素随核电荷数增大,半径逐渐减小,第三周期半径最大的原子是Na,同周期元素随核电荷数增大,非金属性越强,气态氢化物的稳定性逐渐增强,第三周期氢化物最稳定的元素是Cl;
(4)1molN2(g)与适量O2(g)起反应,生成NO(g),吸收68kJ热量,反应吸热时焓变值为正值,所以该反应的热化学方程式为N2(g)+2O2(g)=2NO(g)△H=+68kJmol-1。


科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期主族元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示的变化,其中A为X、Y组成的双原子分子,B和C均为10电子分子。下列说法不正确的是( )
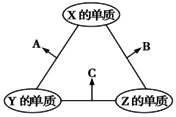
A.X元素位于第VIA族B.A不能溶于B中
C.A是典型的酸性氧化物D.B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是一种常用的净水剂,甲、乙两小组分别用如图装置制备无水FeCl3并证明产品中没有FeCl2,已知无水FeCl3在空气中易潮解,加热易升华。
I.小组甲拟用如图实验装置来制备无水FeCl3。(每个虚线框表示一个单元装置)
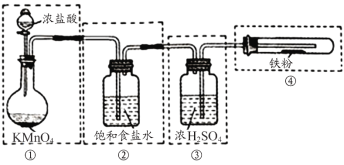
(1)请用文字描述方法改正以上装管的两处错误__________________________。
II.小组乙用下列装置组装制备无水FeCl3。
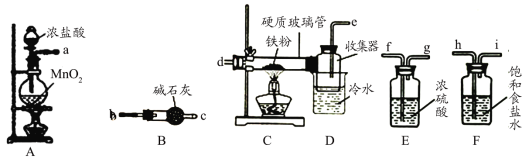
(2)A中发生反应的离子方程式为______________________________。
(3)装置接口的连接顺序为________(用a、b、c……i表示):反应开始前应先点燃____处酒精灯(填“A”或“C”)。
(4)装置B的作用______________________________。
(5)证明产品中没有FeCl2的试剂是____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可降解聚合物P的合成路线如下

(1)A的含氧官能团名称是____________。
(2)羧酸a的电离方程是________________。
(3)B→C的化学方程式是_____________。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是___________。
(5)E→F中反应①和②的反应类型分别是___________。
(6)F的结构简式是_____________。
(7)聚合物P的结构简式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如下:
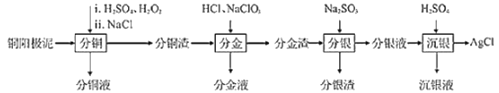
已知:ⅰ.分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ.分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-Ag++2SO32-
ⅲ.“分铜”时各元素的浸出率如表所示。

(1)由表中数据可知,Ni的金属性比Cu______。分铜渣中银元素的存在形式为(用化学用语表示)______。
(2)“分金”时,单质金发生反应的离子方程式为______。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。
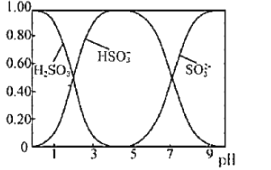
“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为______。调节溶液的pH不能过低,理由为______(用离子方程式表示)。
(4)工业上,用镍为阳极,电解0.1mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:
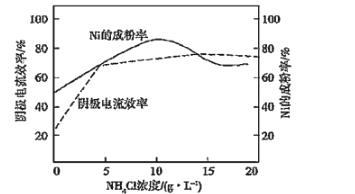
为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为______g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液导电能力越强,电导率越大。常温下用0.1000 mol/L盐酸分别滴定10.00 mL浓度均为0.1000 mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液{二甲胺在水中电离与氨相似,已知在常温下Kb[(CH3)2NH·H2O]=1.6×10-4},利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
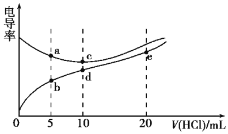
A.盐酸滴定二甲胺实验中选择酚酞作指示剂比选甲基橙误差更小
B.d点溶液中:c(H+)>c(OH-)+c[(CH3)2NH2+]
C.b、c、d、e四点的溶液中,水的电离程度最大的是d点
D.a点溶液与d点的溶液混合后的溶液中: c(OH-) < c(H+) < c[(CH3)2 NH2+] <c(Na+)< c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将含等物质的量的硫酸亚铁和硫酸铁的溶液混合,再滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在![]() 的磁流体。下列说法中正确的是( )
的磁流体。下列说法中正确的是( )
A.该磁流体是一种纯净物B.所得的磁流体为悬浊液
C.该磁流体很不稳定D.所得的磁流体能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液中可能大量存在![]() 、
、![]() 、
、![]() 中的几种离子。
中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是_____。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,原溶液中肯定有的离子是___。
(3)取(2)的滤液加入过量![]() ,出现白色沉淀,说明原溶液中肯定存在的离子有_____,离子反应方程式为____。
,出现白色沉淀,说明原溶液中肯定存在的离子有_____,离子反应方程式为____。
(4)原溶液中可能大量存在的阴离子是下列![]() 中的(填序号)_____。
中的(填序号)_____。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为M的气态化合物VL(标准状况)溶于mg水中,得到溶液的质量分数为ω%,物质的量浓度cmol/L,密度为ρg/cm3,则下列说法正确的是
A. 相对分子质量M可表示为:![]()
B. 溶液密度ρ可表示为:![]()
C. 溶液的质量分数ω%可表示为:![]()
D. 物质的量浓度C可表示为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com