
一般情况下,较强的氧化剂如:MnO2、KMnO4、KClO3、Ca(ClO)2等氧化浓盐
酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气。实验室通常用该原
理制取少量Cl2。现将214.5gCa(ClO)2放入500 mL 12.0 mol/L的浓盐酸中,生成的Cl2
在标准状况下的体积为39.2 L。试计算:
(1)该反应消耗的氧化剂的质量是
(2)若反应前后溶液的体积保持不变,则反应后溶液中HCl的物质的量浓度为 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.铁溶于稀硫酸中:2Fe +6H+=2Fe3++3H2↑
+6H+=2Fe3++3H2↑
B.二氧化硫与足量烧碱溶液反应:SO2+2OH-=SO32-+H2O
C.醋酸溶液与氢氧化钠溶液反应:H++OH-=H2O
D.浓盐酸与MnO2反应制Cl2:MnO2+2H++2C1- 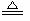 C12↑+Mn2++H2O
C12↑+Mn2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
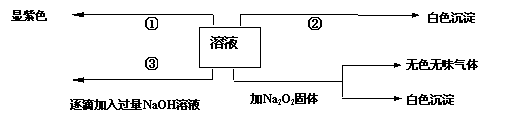
有一无色溶液,可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
|
|
|
白色沉淀
在第③个实验中,生成白色沉淀的量与加入NaOH的量有右图
所示的相互关系。据此可知:
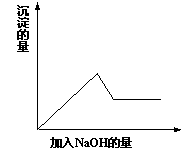 ⑴在原溶液中一定不存在的离子有_____________________。
⑴在原溶液中一定不存在的离子有_____________________。
⑵为满足该溶液中一定存在的离子的要求,一般可溶解两
种常见物质为(写化学式)___________和_________。
⑶写出第③个实验中发生反应的离子方程式
____________________ ___ ___
。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:还原性HSO3->I-,氧化性IO3->I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3
溶液。加入KIO3和析出I2的物质的量的关系曲线如下图所示。下列说法不正确的是

A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中I-与I2的物质的量之比为5:2时,加入的KIO3为0.18mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
查看答案和解析>>
科目:高中化学 来源: 题型:
有以下几种物质①熔融氯化钠 ②浓硫酸 ③Cu ④蔗糖 ⑤CH3COOH
⑥NaHCO3 ⑦酒精 ⑧液溴,填空回答:(填序号)
(1)以上物质中属于强电解质的是 ; 属于非电解质的是 ;
(2)写出⑤⑥在水中的电离方程式:⑤ ;⑥ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某稀溶液中含4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol铁,充分反应后产生的NO气体在标准状况下的体积为( )
A.36 L B.28 L
C.22.4 L D.11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:
NaNO2+HI―→NO+I2+NaI+H2O(未配平)
(1)上述反应的氧化剂是________;若有1 mol的还原剂被氧化,则反应中转移电子的数目是________。
(2)根据上述反应,可用试剂和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋。下列几组中最合适的是________(填序号)。
A.①② B.①②④
C.①②⑤ D.③⑤
(3)某工厂废液中含有2%~5%的NaNO2,直接排放会造成污染,采用NH4Cl能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为___________________________
________________________________________________________________________。
(4)采用烧碱处理硝酸工业尾气(NO、NO2)可以获得副产品NaNO2,变废为宝。若采用a L b mol/L的烧碱处理硝酸工业尾气,最多可以获得NaNO2的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2===LiNH2+LiH,下列有关说法正确的是( )
A.Li2NH中N的化合价是-1
B.该反应中H2既是氧化剂又是还原剂
C.Li+和H-的离子半径相等
D.此法储氢和钢瓶储氢的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
环境问题是2014年北京APEC关注的问题之一,环境污染的发生、危害与防治都与化学有关。下列措施和目的之间关系正确的是
A.在新装修的室内摆放适宜的花卉——改善室内空气质量
B.限制生产、使用含磷洗涤剂——防止出现“臭氧空洞”
C.严禁排放未经处理的有毒工业废水——防止水土流失
D.给汽车安装尾气净化装置——减少氮的氧化物及一氧化碳的排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com