
【题目】按照要求将相应序号填入空白中:
①![]() ②金刚石 ③CO ④CO2 ⑤37Cl ⑥
②金刚石 ③CO ④CO2 ⑤37Cl ⑥![]() ⑦SO2 ⑧
⑦SO2 ⑧![]() ⑨石墨
⑨石墨
其中________互为同位素,______为酸性氧化物,_____的质量数相等,但不能互为同位素,_______互称同素异形体。
【答案】①⑤ ④⑦ ⑥⑧ ②⑨
【解析】
同位素是质子数相同而中子数不同的原子;若两种原子质子数不同,中子数不同,但二者的和相等,二者的关系是质量数相同;酸性氧化物是与碱反应产生盐和水的氧化物;同素异形体是由同种元素组成的不同性质的单质,据此分析解答。
①![]() 与⑤37Cl质子数都是17,质子数相同,而中子数前者是18,后者是20,二者的关系是同位素即:属于同位素的是①⑤;
与⑤37Cl质子数都是17,质子数相同,而中子数前者是18,后者是20,二者的关系是同位素即:属于同位素的是①⑤;
④CO2与NaOH反应产生Na2CO3、H2O,因此CO2是酸性氧化物;⑦SO2与NaOH反应产生Na2SO3、H2O,因此SO2是酸性氧化物;因此属于酸性氧化物的是④⑦;
⑥![]() 和⑧
和⑧![]() 中子数不同,质子数不同,但质量数都是14,二者相同,故合理选项是⑥⑧;
中子数不同,质子数不同,但质量数都是14,二者相同,故合理选项是⑥⑧;
②金刚石和⑨石墨都是C元素的单质,二者结构不同,性质不同,互为同素异形体,故合理选项是②⑨。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一体积为2 L的密闭容器中充入2 mol X,一定条件下可发生反应:2X(g)![]() 3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
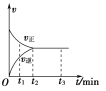
A. t1 min时,只有正反应发生
B. t2~t3 min内,v(X)正=0,反应已经停止
C. 0~t2 min内,v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
D. 若t3 min时升高温度,则反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2) 制取MnSO4·H2O并回收单质硫的工艺流程如下:
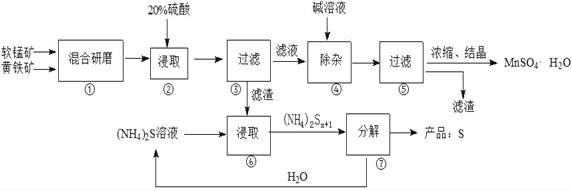
已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是_____________________________________________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为_____________________________________。
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入______________________;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH为4~5,再继续煮沸一段时间,“继续煮沸”的目的是_____________________________________。步骤⑤所得滤渣为__________________(填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为_________________________________。
(4)测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1KMnO4标准溶液滴定至浅红色且半分钟不褪色,消耗标准溶液VmL,产品中Mn2+的质量分数为w(Mn2+)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是
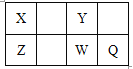
A. 钠与Y可能形成Na2Y2化合物 B. W得电子能力比Q强
C. 由W与Y组成的物质在熔融时能导电 D. X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(ρ=1.84g/cm3)配制1mol/L的稀硫酸240mL。
(1)选用的主要仪器有:玻璃棒、烧杯、量筒___________________。
(2)需要用量筒量取98%的浓硫酸的体积为_____________;如果实验室有10mL、20mL、50mL的量筒,则所需要的浓硫酸应选用________mL的量筒。
(3)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4 B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线 D.洗净2-3次并转入容量瓶
E.稀释浓H2SO4 F.将溶液转入容量瓶
其操作正确的顺序依次为___________________。
(4)下列操作会使所配的溶液浓度偏大的是_____________(填选项字母)。
A.配制前,量取浓硫酸时发现量筒不干净,用水洗净后直接量取
B.将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌,搅拌过程中有液体溅出
C.转入容量瓶前液体未冷却至室温即定容
D.洗涤烧杯和玻璃棒2~3次,洗涤液未转入容量瓶
E.定容时俯视容量瓶的刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】托盘天平的两个托盘上各放一只相同的烧杯,再分别向两烧杯中放入等质量、等质量分数且足量的稀硫酸,调节天平至平衡。然后,向一只烧杯中加入一定质量的镁,向另一烧杯中加入等质量的铜、铝合金,反应后天平仍然保持平衡。则该合金中铜与铝的质量比为( )
A. 64∶27B. 8∶3C. 3∶1D. 1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的镁和铜组成的混合物加入到过量的稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。则下列叙述中错误的是
A. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=100ml
B. 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
C. 参加反应的金属的总质量为9.6g>m>3.6g
D. 当金属全部溶解时收集到NO气体的体积在标准状况下一定为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).下列说法错误的是( )

A. A、B、D可能是钠及其化合物 B. A、B、D可能是镁及其化合物
C. A、B、D可能是铝及其化合物 D. A、B、D可能是非金属及其化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,N2O分解的部分实验数据如下( )
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
A.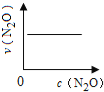 B.
B.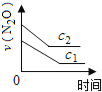 C.
C.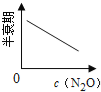 D.
D.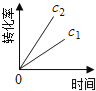
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com