
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量碳及二氧化硅)为原料制备的流程如下:
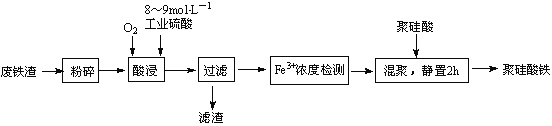
(1)废铁渣进行“粉碎”的目的是____________。
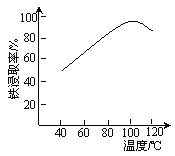
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如右图所示:
①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为___________。
②酸浸时,通入O2的目的是_____________,该反应的离子方程式为_________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是____________。
(3)滤渣的主要成分为____________(填化学式)。
(4)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为______________。
【答案】 减小颗粒直径,增大浸取时的反应速率和提高铁浸取率 Fe3O4+4H2SO4![]() FeSO4+Fe2(SO4)3+4H2O 将FeSO4氧化为Fe2(SO4)3 4Fe2++O2+4H+==4Fe3++2H2O 温度超过100℃明显加快了Fe3+水解反应的速率,导致Fe3+浓度降低 C和SiO2 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
FeSO4+Fe2(SO4)3+4H2O 将FeSO4氧化为Fe2(SO4)3 4Fe2++O2+4H+==4Fe3++2H2O 温度超过100℃明显加快了Fe3+水解反应的速率,导致Fe3+浓度降低 C和SiO2 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
【解析】(1)对废铁渣进行粉碎的目的:减小颗粒直径,增大浸取时的反应速率和提高铁浸取率;故答案为:减小颗粒直径,增大浸取时的反应速率和提高铁浸取率;
(2)①加热条件下酸浸时,Fe3O4与硫酸反应生成硫酸铁和硫酸亚铁,方程式为:Fe3O4+4H2SO4![]() FeSO4+Fe2(SO4)3+4H2O;故答案为:Fe3O4+4H2SO4
FeSO4+Fe2(SO4)3+4H2O;故答案为:Fe3O4+4H2SO4![]() FeSO4+Fe2(SO4)3+4H2O;
FeSO4+Fe2(SO4)3+4H2O;
②酸浸时有亚铁离子生成,通入氧气能将亚铁离子氧化为铁离子;反应的离子方程式为4Fe2++O2+4H+==4Fe3++2H2O,故答案为:将FeSO4氧化为Fe2(SO4)3;4Fe2++O2+4H+==4Fe3++2H2O;
③铁离子在水溶液中存在水解,温度升高有利于水解反应的进行,温度超过100℃明显加快了Fe3+水解反应的速率,导致Fe3+浓度降低;故答案为:温度超过100℃明显加快了Fe3+水解反应的速率,导致Fe3+浓度降低;
(3)废铁渣(主要成分Fe3O4,少量碳及二氧化硅),酸浸,碳与二氧化硅不溶于稀硫酸也不反应,故滤渣的主要成分问碳和二氧化硅;故答案为:C和SiO2;
(4)在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),则亚铁离子被氧化为铁离子,发生的离子方程式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D是按原子序数由小到大排列的前20号元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1:2。在一定条件下,各物质之间的相互转化关系如右(部分产物未列出):
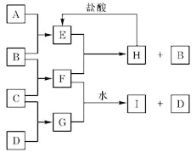
(1)A是_____,C是______ (填元素名称)。
(2)H与盐酸反应生成 E 的化学方程式是_________。
(3)E与F反应的化学方程式是___________。
(4)F与G的水溶液反应生成I和D的离子方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮的变化关系图如图:
![]()
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.上述路线的所有反应中只有I属于氮的固定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物麻黄碱和牛磺酸的结构简式如图。有关麻黄碱、牛磺酸的叙述正确的是
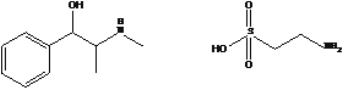
麻黄碱 牛磺酸
A.分子式分别为 C10H16ON、C2H7NO2S
B.均能发生取代反应,麻黄碱还能发生加成反应
C.均能与金属钠及氢氧化钠溶液反应
D.牛磺酸与HSCH2CH( NH2)COOH( 半胱氨酸) 互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上氟气可作为火箭燃料中的氧化剂,氟单质的制备通常采用电解法。已知:KF+HF===KHF2,电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物制备F2的装置如图所示。下列说法错误的是
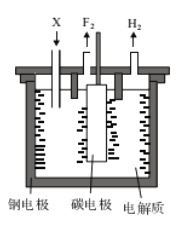
A. 钢电极与电源的负极相连
B. 电解过程中需不断补充的X是KF
C. 阴极室与阳极室必须隔开
D. 氟氢化钾在氟化氢中可以电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。根据已知信息回答下列问题:
(1)已知:P和Cl2分两步反应生成1mol PCl5的热化学方程式:
P(s)+3/2Cl2(g)![]() PCl3(g) △H1=-306kJ/mol
PCl3(g) △H1=-306kJ/mol
Cl2(g)+PCl3(g)![]() PCl5(g) △H2=-93kJ/mol
PCl5(g) △H2=-93kJ/mol
①P和Cl2一步反应生成1molPCl5的△H3=______________ kJ/mol。
②工业上制备PCl5通常也分两步进行,通常将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5,原因是____________________________________________。
③PCl5与足量水充分反应,最终生成两种酸,其中一种是P的最高价含氧酸,其化学方程
式是________________________________________________________。
(2)反应PCl3(g)+Cl2(g)![]() PCl5(g)在容积为10L的密闭容器中进行。起始时PCl3和Cl2均为0.2mol,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
PCl5(g)在容积为10L的密闭容器中进行。起始时PCl3和Cl2均为0.2mol,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

温馨提示:同温同容下的气体,压强之比就等于物质的量之比
①已知实验b平衡时气体的总物质的量为0.30mol,计算实验b反应开始至达到平衡时的反应速率v(PCl5)=_______________,PCl3的平衡转化率为__________________。
②图中3组实验从反应开始至达到平衡时的反应速率v(PCl5)由小到大的次序为____(填实验序号);与实验a相比,c组改变的实验条件是升高温度,判断依据是_________,若α表示PCl3的平衡转化率,实验a和c的平衡转化率:αa______αc(填“<”或“>”);b组改变的实验条件是加入了催化剂,判断依据是_______________________________。
③用p0表示开始时总压强,p表示平衡时总压强,则α(表示PCl3的平衡转化率)的表达式为____(用p0,p表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家开发设计一种天然气脱硫装置,利用如右图装置可实现:H2S+O2→H2O2 +S。已知甲池中有如下的转化:


下列说法错误的是:
A. 该装置可将光能转化为电能和化学能
B. 该装置工作时,溶液中的H+从甲池经过全氟磺酸膜进入乙池
C. 甲池碳棒上发生电极反应:AQ+2H+ +2e- =H2AQ
D. 乙池①处发生反应:H2S+I3- =3I-+S↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,实验探究能激发学生学习化学的兴趣。某化学兴趣小组设计如图实验装置(夹持设备已略)制备氯气并探究氯气及其卤族元素的性质。回答下列问题:
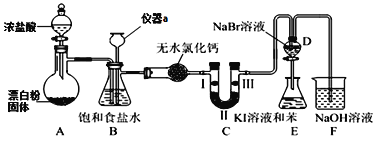
(1)仪器a的名称是______________。
(2)A装置中发生的化学反应方程式为_________________________________。若将漂白粉换成KClO3,则反应中每生成21.3g Cl2时转移的电子数目为____NA。
(3)装置B可用于监测实验过程中C处是否堵塞,若C处发生了堵塞,则B中可观察到__________。
(4)装置C的实验目的是验证氯气是否具有漂白性,此时C中Ⅰ、Ⅱ、Ⅲ依次可放入____(填选项a或b或c)。
选项 | Ⅰ | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
b | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
c | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可观察到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴,打开活塞,将D中少量溶液加入E中,振荡E,观察到的现象是_______________________________,该现象_____(填“能”或“不能”)说明溴的非金属性强于碘,原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,近年来发现了一种新的星际分子,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子)。
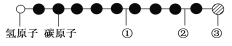
下列对该物质的说法中正确的是
A. ①处的化学键表示碳碳双键 B. ②处的化学键表示碳碳单键
C. ③处的原子可能是氯原子或氟原子 D. 此星际分子属于烃类
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com